Objetivos
Ao final desta seção, você será capaz de:
- Descrevem como os elétrons foram descobertos.explique o experimento Millikan de queda de óleo.descreve a experiência de Rutherford em folha de ouro.descreve o modelo planetário do átomo de Rutherford.
assim como os átomos são uma subestrutura de matéria, elétrons e núcleos são subestruturas do átomo., Os experimentos que foram usados para descobrir elétrons e núcleos revelam algumas das propriedades básicas dos átomos e podem ser facilmente compreendidos usando ideias como a força eletrostática e magnética, já cobertas em capítulos anteriores.
cargas e forças eletromagnéticas
em discussões anteriores, temos observado que a carga positiva está associada com núcleos e carga negativa com elétrons. Também temos coberto muitos aspectos das forças elétricas e magnéticas que afetam cargas., Vamos agora explorar a descoberta do electrão e do núcleo como subestruturas do átomo e examinar as suas contribuições para as propriedades dos átomos.
o electrão

Figura 1. Um tubo de descarga de gás brilha quando uma alta tensão é aplicada a ele. Elétrons emitidos a partir do cátodo são acelerados em direção ao ânodo; eles excitam átomos e moléculas no gás, que brilham em resposta., Uma vez chamados tubos Geissler e mais tarde tubos Crookes, eles são agora conhecidos como tubos de raios catódicos (CRTs) e são encontrados em TVs mais antigos, telas de computador e máquinas de raios x. Quando um campo magnético é aplicado, o feixe dobra na direção esperada para carga negativa. (crédito: Paul Downey, Flickr)
tubos de descarga de gás, como o mostrado na Figura 1, consistem num tubo de vidro evacuado contendo dois eléctrodos de metal e um gás rarefeito. Quando uma alta tensão é aplicada aos eletrodos, o gás brilha. Estes tubos foram os precursores das luzes de néon de hoje., Eles foram primeiro estudou a sério por Heinrich Geissler, um inventor alemão e de vidro, a partir de 1860. O cientista inglês William Crookes, entre outros, continuaram a estudar o que por algum tempo foram chamados de tubos de Crookes, no qual elétrons são liberados a partir de átomos e moléculas na rarefação do gás dentro do tubo e são acelerados a partir do cátodo (negativo) para o ânodo (positivo) pelo alto potencial., Estes “raios catódicos” colidem com os átomos e moléculas de gás e os excitam, resultando na emissão de radiação eletromagnética (EM) que torna o caminho dos elétrons visível como um raio que se espalha e desaparece à medida que se afasta do cátodo.
tubos de descarga de gás hoje são mais comumente chamados de tubos de raios catódicos, porque os raios se originam no cátodo. Crookes mostrou que os elétrons carregam momento (eles podem fazer uma pequena roda de remo girar)., He also found that their normally straight path is bent by a magnet in the direction expected for a negative charge moving away from the cathode. Estas foram as primeiras indicações diretas dos elétrons e sua carga.

Figura 2. J. J. Thomson (crédito: www.firstworldwar.com, via Wikimedia Commons)
the English physicist J. J. Thomson (1856-1940) improved and expanded the scope of experiments with gas descarregation tubes. (Ver Figura 2 e Figura 3., Ele verificou a carga negativa dos raios catódicos com campos magnéticos e elétricos. Além disso, ele coletou os raios em um copo de metal e encontrou um excesso de carga negativa. Thomson também foi capaz de medir a razão da carga do elétron para sua massa, \frac{q_e}{m_e}\\ \ —um passo importante para encontrar os valores reais de qe e de mim. A figura 4 mostra um tubo de raios catódicos, que produz um feixe estreito de elétrons que passa através de placas de carga conectadas a uma fonte de alimentação de alta tensão., Um campo elétrico E é produzido entre as placas de carregamento, e o tubo de raios catódicos é colocado entre os pólos de um íman de modo que o campo elétrico E é perpendicular ao campo magnético B do íman. Estes campos, sendo perpendiculares uns aos outros, produzem forças opostas sobre os elétrons. Como discutido para espectrómetros de massa em Mais aplicações do magnetismo, se a força líquida devido aos campos desaparecer, então a velocidade da partícula carregada é v=\frac{e}{B}\\., Desta forma, Thomson determinou a velocidade dos elétrons e, em seguida, moveu o feixe para cima e para baixo, ajustando o campo elétrico.

Figura 3. Diagrama do CRT de Thomson. (crédito: Kurzon, Wikimedia Commons)

Figura 4. Este esquema mostra o feixe de elétrons em um CRT passando por campos elétricos e magnéticos cruzados e fazendo com que o fósforo brilhe quando atinge a extremidade do tubo.
reunindo Termos, temos \frac{q_e}{m_e}=\frac{a}{e}\\.,
O que é tão importante sobre \frac{q_e}{m_e}\\, a relação da carga do electrão com a sua massa? O valor obtido é
\displaystyle\frac{q_e}{m_e}=-1.76\times10^{11}\text{ C/kg (elétron)}\\
Este é um número enorme, como Thomson percebeu, e isso implica que o elétron tem uma muito pequena de massa. Era sabido por eletroplating que cerca de 108 C / kg é necessário para placa um material, um fator de cerca de 1000 menos do que a carga por quilograma de elétrons., Thomson passou a fazer o mesmo experimento para íons de hidrogênio positivamente carregados (agora conhecidos por serem prótons nus) e encontrou uma carga por quilograma cerca de 1000 vezes menor do que a do elétron, implicando que o próton é cerca de 1000 vezes mais massivo do que o elétron. Hoje, sabemos mais precisamente, o que
\displaystyle\frac{q_p}{m_p}=9.58\times10^{7}\text{ C/kg (prótons)}\\,
onde qp é a carga do próton e mp é a sua massa. Esta razão (para quatro números significativos) é 1836 vezes menor carga por quilograma do que para o elétron., Uma vez que as cargas de elétrons e prótons são iguais em magnitude, isto implica mp = 1836me.Thomson realizou uma variedade de experimentos usando diferentes gases em tubos de descarga e empregando outros métodos, como o efeito fotoelétrico, para libertar elétrons dos átomos. Ele sempre encontrou as mesmas propriedades para o elétron, provando que ele é uma partícula independente. Por seu trabalho, as peças importantes das quais ele começou a publicar em 1897, Thomson foi premiado com o Prêmio Nobel de Física de 1906., Em retrospectiva, é difícil perceber o quão surpreendente foi descobrir que o átomo tem uma subestrutura. Thomson disse: “Foi só quando eu estava convencido de que a experiência não deixou escapatória que eu publiquei minha crença na existência de corpos menores que átomos.”
Thomson tentou medir a carga de elétrons individuais, mas seu método poderia determinar sua carga apenas para a ordem de magnitude esperada.desde os experimentos de Faraday com eletroplating na década de 1830, sabia-se que cerca de 100.000 C por mula eram necessários para placas de íons ionizados., Dividindo isto pelo número de íons por mol (ou seja, pelo número de Avogadro), que era aproximadamente conhecido, a carga por íon foi calculada em cerca de 1,6 × 10-19 c, próximo ao valor real.

Figura 5. Robert Millikan (crédito: Desconhecido Autor, via Wikimedia Commons)
Um físico Americano Robert Millikan (1868-1953) (ver Figura 5), decidiu melhorar o experimento de Thomson para medir qe e foi forçado a tentar outra abordagem, que é hoje um clássico experimento realizado pelos alunos., A experiência de queda de óleo Millikan é mostrada na Figura 6.no experimento Millikan de queda de óleo, gotas finas de óleo são pulverizadas de um atomizador. Alguns destes são carregados pelo processo e podem então ser suspensos entre placas de metal por uma tensão entre as placas. Nesta situação, o peso da gota é equilibrada pela força elétrica:
m dropg = qe E

Figura 6., O experimento Millikan oil drop produziu a primeira medição direta precisa da carga sobre elétrons, uma das constantes mais fundamentais na natureza. Gotas finas de óleo ficam carregadas quando pulverizadas. Seu movimento é observado entre placas de metal com um potencial aplicado para se opor à força gravitacional. O equilíbrio das forças gravitacionais e elétricas permite o cálculo da carga em uma gota. A carga é quantizada em unidades de -1,6 × 10-19 C, determinando diretamente a carga do excesso e elétrons em falta nas gotas de óleo.,
o campo elétrico é produzido pela tensão aplicada, portanto, E=\frac{V}{D}\\, E V é ajustado apenas para equilibrar o peso da queda. As gotas podem ser vistas como pontos de luz refletida usando um microscópio, mas elas são muito pequenas para medir diretamente o seu tamanho e massa. A massa da gota é determinada observando a velocidade da queda quando a tensão é desligada. Uma vez que a resistência do ar é muito significativa para estas gotas submicroscópicas, as gotas mais massivas caem mais rápido do que as menos massivas, e cálculos sofisticados de sedimentação podem revelar sua massa., O óleo é usado ao invés de água, porque não evapora facilmente, e assim a massa é quase constante. Uma vez que a massa da gota é conhecido, a carga do elétron é dada rearranjando a equação anterior:
\displaystyle{q}=\frac{m_{\text{queda}}g}{B}=\frac{m_{\text{queda}}gd}{V}\\,
, onde d é a separação das placas e V é a tensão que mantém a gota imóvel. (A mesma gota pode ser observada por várias horas para ver que é realmente imóvel.,) Em 1913 Millikan tinha mediu a carga do elétron qe para uma precisão de 1%, e ele melhorou este por um fator de 10, dentro de alguns anos para um valor de -1.60 × 10-19 C. Ele também observou que todas as acusações foram agrupados de base elétron de carga e que mudanças bruscas podem ocorrer na qual elétrons foram adicionados ou removidos do cai. Millikan foi agraciado com o Nobel de Física de 1923, por esta medida direta fundamental de qe e por seus estudos do efeito fotoelétrico.,com a carga do elétron conhecida e a razão carga-massa conhecida, a massa do elétron pode ser calculada. É
\displaystyle{m}=\frac{q_e}{\left(\frac{q_e}{m_e}\right)}\\
Substituindo os valores conhecidos rendimentos
\displaystyle{m}_e=\frac{-1.60\times10^{-19}\text{ C}}{-1.76\times10^{11}\text{ C/kg}}\\
ou me = 9.11 × 10-31 kg (elétron de massa), onde os erros de arredondamento foram corrigidas., A massa do elétron foi verificada em muitos experimentos subsequentes e agora é conhecida por uma precisão de melhor do que uma parte em um milhão. É uma massa incrivelmente pequena e permanece a menor massa conhecida de qualquer partícula que tenha massa. (Algumas partículas, como fótons, são sem massa e não podem ser trazidas para descansar, mas viajam à velocidade da luz. Um cálculo similar dá as massas de outras partículas, incluindo o próton. Para três dígitos, a massa do próton é agora conhecida como mp = 1,67 × 10-27 kg( Massa do próton), que é quase idêntica à massa de um átomo de hidrogênio., O que Thomson e Millikan fizeram foi provar a existência de uma subestrutura de átomos, o elétron, e ainda mostrar que ele tinha apenas uma pequena fração da massa de um átomo. O núcleo de um átomo contém a maior parte da sua massa, e a natureza do núcleo foi completamente imprevista.outra característica importante da mecânica quântica também estava começando a emergir. Todos os elétrons são idênticos um ao outro. A carga e a massa dos elétrons não são valores médios, mas valores únicos que todos os elétrons têm., Isto é verdade para outras entidades fundamentais no nível submicroscópico. Todos os protões são idênticos um ao outro, e assim por diante.
o núcleo
aqui, examinamos a primeira evidência direta do tamanho e massa do núcleo. Em capítulos posteriores, vamos examinar muitos outros aspectos da física nuclear, mas a informação básica sobre o tamanho e massa nuclear é tão importante para entender o átomo que nós o consideramos aqui.a radioatividade Nuclear foi descoberta em 1896, e logo foi objeto de intenso estudo por vários dos melhores cientistas do mundo., Entre eles estava o Neozelandês Lord Ernest Rutherford, que fez inúmeras descobertas fundamentais e ganhou o título de “pai da física nuclear”. Nascido em Nelson, Rutherford fez seus estudos de pós-graduação nos laboratórios Cavendish na Inglaterra antes de assumir uma posição na Universidade McGill no Canadá, onde ele fez o trabalho que lhe rendeu um Prêmio Nobel de Química em 1908. Na área da Física Atômica e nuclear, há muita sobreposição entre química e física, com a física fornecendo as teorias facilitadoras fundamentais., Ele retornou à Inglaterra nos últimos anos e teve seis futuros ganhadores do Prêmio Nobel como estudantes. Rutherford usou radiação nuclear para examinar diretamente o tamanho e a massa do núcleo atômico. A experiência que ele criou é mostrada na Figura 7. Uma fonte radioativa que emite radiação alfa foi colocado em um recipiente de chumbo com um orifício de um lado, para produzir um feixe de partículas alfa, que são um tipo de radiação ionizante ejetado pelos núcleos de uma fonte radioativa., Uma fina folha de ouro foi colocada no feixe, e o espalhamento das partículas alfa foi observado pelo brilho que eles causaram quando eles atingiram uma tela de fósforo.

Figura 5. O experimento de Rutherford deu evidências diretas para o tamanho e massa do núcleo espalhando partículas alfa de uma fina folha de ouro. Partículas alfa com energias de cerca de 5MeV são emitidas de uma fonte radioativa (que é um pequeno recipiente metálico no qual uma quantidade específica de um material radioativo é selado), são colimadas em um feixe, e caem sobre a folha., O número de partículas que penetram a folha ou se dispersam para vários ângulos indica que os núcleos de ouro são muito pequenos e contêm quase toda a massa do átomo de ouro. Isto é particularmente indicado pelas partículas alfa que se espalham em ângulos muito grandes, como uma bola de futebol saltando da cabeça de um guarda-redes.,
as partículas Alfa eram conhecidos para ser duplamente cobrado positivo núcleos de átomos de hélio, que tinha cinética energias da ordem de 5 MeV, quando emitido no decaimento nuclear, que é a desintegração do núcleo de um nuclídeo instável por emissão espontânea de partículas carregadas. Estas partículas interagem com a matéria principalmente através da força de Coulomb, e a maneira pela qual elas se dispersam dos núcleos pode revelar tamanho e massa nuclear. Isto é análogo à observação de como uma bola de bowling é espalhada por um objecto que não consegue ver directamente., Uma vez que a energia da partícula alfa é tão grande em comparação com as energias típicas associadas aos átomos (MeV versus eV), seria de esperar que as partículas alfa simplesmente colidissem com uma fina folha, tal como uma bola de bowling supersónica colidisse com algumas dúzias de pinos de bowling. Thomson tinha imaginado que o átomo fosse uma pequena esfera na qual quantidades iguais de carga positiva e negativa fossem distribuídas uniformemente. O incidente as partículas alfa maciças sofreriam apenas pequenas deflexões em tal modelo., Em vez disso, Rutherford e seus colaboradores descobriram que partículas alfa ocasionalmente eram espalhadas por grandes ângulos, alguns até mesmo na direção de onde vieram! Análise detalhada usando a conservação do momento e da energia-particularmente do pequeno número que veio diretamente para trás-implicou que os núcleos de ouro são muito pequenos em comparação com o tamanho de um átomo de ouro, contêm quase toda a massa do átomo, e estão estreitamente ligados. Uma vez que o núcleo de ouro é várias vezes mais massivo que a partícula alfa, uma colisão frontal espalharia a partícula alfa diretamente para a fonte., Além disso, quanto menor o núcleo, menos partículas alfa atingiriam uma cabeça.embora os resultados da experiência tenham sido publicados por seus colegas em 1909, Rutherford levou dois anos para se convencer de seu significado. Como Thomson antes dele, Rutherford estava relutante em aceitar resultados tão radicais. A natureza em pequena escala é tão diferente de nosso mundo clássico que mesmo aqueles na vanguarda da descoberta são às vezes surpreendidos. Rutherford mais tarde escreveu: “foi quase tão incrível como se você tivesse disparado uma concha de 15 polegadas em um pedaço de papel tissue e ele voltou e bateu em você., Pensando bem, apercebi-me de que isto se estava a espalhar para trás . . . . . . a maior parte da massa do átomo estava concentrada num núcleo minúsculo.”
em 1911, Rutherford publicou sua análise juntamente com um modelo proposto do átomo. O tamanho do núcleo foi determinado para ser cerca de 10-15 m, ou 100.000 vezes menor que o átomo. Isto implica uma enorme densidade, na ordem de 1015 g/cm3, muito diferente de qualquer matéria macroscópica. Também está implícita a existência de forças nucleares previamente desconhecidas para neutralizar as enormes forças repulsivas de Coulomb entre as cargas positivas no núcleo., Grandes forças também seriam consistentes com as grandes energias emitidas na radiação nuclear.

Figura 8. An expanded view of the atoms in the gold foil in Rutherford’s experiment. Os círculos representam os átomos (cerca de 10-10 m de diâmetro), enquanto os pontos representam os núcleos (cerca de 10-15 m de diâmetro). Para ser visível, os pontos são muito maiores do que a escala. A maioria das partículas alfa colidem, mas não são relativamente afetadas por causa de sua alta energia e da pequena massa do elétron., Alguns, no entanto, dirigem-se diretamente para um núcleo e são espalhados para trás. Uma análise detalhada dá o tamanho e a massa do núcleo.
o pequeno tamanho do núcleo também implica que o átomo está principalmente vazio no interior. Na verdade, no experimento de Rutherford, a maioria dos Alfas passou diretamente pela folha de ouro com muito pouco espalhamento, uma vez que os elétrons têm massas tão pequenas e desde que o átomo estava quase vazio sem nada para o Alfa bater., Já havia indícios disso na época em que Rutherford realizou seus experimentos, uma vez que elétrons energéticos tinham sido observados para penetrar folhas finas mais facilmente do que o esperado. A figura 8 mostra um esquema dos átomos em uma fina folha com círculos representando o tamanho dos átomos (cerca de 10-10 m) e pontos representando os núcleos. (Os pontos não são à escala—se fossem, você precisaria de um microscópio para vê-los.) A maioria das partículas alfa erram os pequenos núcleos e são apenas ligeiramente dispersas por elétrons., Ocasionalmente, (cerca de uma vez em 8000 vezes no experimento de Rutherford), um alfa atinge um núcleo de frente e é espalhado direto para trás.

Figura 9. O modelo planetário do átomo de Rutherford incorpora as características do núcleo, elétrons e o tamanho do átomo. Este modelo foi o primeiro a reconhecer a estrutura dos átomos, em que elétrons de baixa massa orbitam um núcleo muito pequeno e massivo em órbitas muito maiores do que o núcleo. O átomo está praticamente vazio e é análogo ao nosso sistema planetário.,
baseado no tamanho e massa do núcleo revelado por sua experiência, bem como a massa de elétrons, Rutherford propôs o modelo planetário do átomo. O modelo planetário do átomo retrata elétrons de baixa massa orbitando um núcleo de grande massa. Os tamanhos das órbitas de elétrons são grandes comparados com o tamanho do núcleo, com a maior parte vácuo dentro do átomo. Esta imagem é análoga à forma como os planetas de baixa massa no nosso sistema solar orbitam o sol de grande massa em distâncias grandes em comparação com o tamanho do sol., No átomo, a força de Coulomb atraente é análoga à gravitação no sistema planetário. (Ver Figura 9.) Note que um modelo ou imagem mental é necessário para explicar os resultados experimentais, uma vez que o átomo é muito pequeno para ser observado diretamente com luz visível.o modelo planetário do átomo de Rutherford foi crucial para compreender as características dos átomos, e suas interações e energias, como veremos nas próximas seções. Além disso, foi uma indicação de como a natureza é diferente do mundo clássico familiar na pequena escala mecânica quântica., A descoberta de uma subestrutura para toda a matéria sob a forma de átomos e moléculas estava agora a ser dado um passo mais longe para revelar uma subestrutura de átomos que era mais simples do que os 92 elementos então conhecidos. Continuamos buscando subestruturas mais profundas, como as que estão dentro do núcleo, com algum sucesso. Em capítulos posteriores, seguiremos esta busca na discussão de quarks e outras partículas elementares, e olharemos para a direção que a busca parece estar agora se dirigindo.,como Rutherford descobriu a estrutura do átomo sem ser capaz de vê-la? Simular a famosa experiência em que ele refutou o modelo de Pudim De Ameixa do átomo, observando partículas alfa saltando sobre os átomos e determinando que eles devem ter um pequeno núcleo.
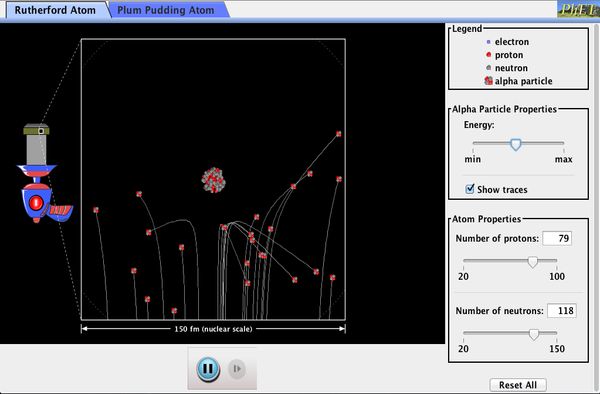
Clique para baixar a simulação. Executar usando Java.,
Seção Resumo
Problemas & Exercícios
- Rutherford encontrou o tamanho do núcleo a ser de cerca de 10-15 m. Isto implicou uma enorme densidade. Qual seria esta densidade para o ouro?em Millikan’s oil-drop experiment, one looks at a small oil drop held unless between two plates. A tensão entre as placas deve ser de 2033 V e a separação das placas de 2,00 cm. A queda de óleo (de densidade 0,81 g / cm3) tem um diâmetro de 4,0 × 10-6 M. encontrar a carga na queda, em termos de unidades elétricas. ,(a) um aspirante a físico quer construir um modelo em escala de um átomo de hidrogênio para seu projeto da Feira de ciência. Se o átomo tem 1,00 m de diâmetro, de que tamanho deve tentar fazer o núcleo? b) quão fácil será fazer isto?