proteínas de membrana
enquanto os lípidos são os elementos estruturais fundamentais das membranas, as proteínas são responsáveis pela realização de funções específicas de membrana. A maioria das membranas plasmáticas consiste em aproximadamente 50% de lípidos e 50% de proteínas em peso, com as porções de hidratos de carbono de glicolípidos e glicoproteínas que constituem 5 a 10% da massa da membrana. Uma vez que as proteínas são muito maiores que os lípidos, esta percentagem corresponde a cerca de uma molécula de proteína por cada 50 a 100 moléculas de lípidos., Em 1972, Jonathan Singer e Garth Nicolson propuseram o modelo de mosaico fluido da estrutura de membrana, que agora é geralmente aceito como o paradigma básico para a organização de todas as membranas biológicas. Neste modelo, membranas são vistas como fluidos bidimensionais em que as proteínas são inseridas em bilayers lipídicos (figura 12.3).

figura 12.3
modelo de mosaico fluido da membrana plasmática., As proteínas integrais da membrana são inseridas na camada intermédia lipídica, enquanto que as proteínas periféricas estão ligadas à membrana indirectamente por interações proteína-proteína. A maioria das proteínas integrais da membrana são transmembranas (mais…)
Singer and Nicolson distinguished two classes of membrane-associated proteins, which they called peripheral and integral membrane proteins., As proteínas da membrana periférica foram definidas operacionalmente como proteínas que se dissociam da membrana após tratamentos com reagentes polares, tais como soluções de pH extremo ou alta concentração de sal, que não perturbam o bilayer fosfolípido. Uma vez dissociadas da membrana, as proteínas da membrana periférica são solúveis em tampões aquosos. Estas proteínas não são inseridas no interior hidrofóbico da camada lipídica. Em vez disso, eles são indiretamente associados com membranas através de interações proteína-proteína., Estas interações frequentemente envolvem ligações iônicas, que são interrompidas por pH extremo ou alto sal.em contraste com as proteínas da membrana periférica, as proteínas integrais da membrana só podem ser libertadas por tratamentos que perturbem a camada intermédia fosfolípida. Porções destas proteínas integrais de membrana são inseridas no bicamador lipídico, para que possam ser dissociadas apenas por reagentes que perturbam as interações hidrofóbicas., Os reagentes mais comumente usados para a solubilização de proteínas integrais de membrana são detergentes, que são pequenas moléculas anfipáticas contendo grupos hidrofóbicos e hidrofílicos (figura 12.4). As porções hidrofóbicas de detergentes desloca os lípidos da membrana e se ligam às porções hidrofóbicas das proteínas integrais da membrana. Como a outra extremidade da molécula de detergente é hidrofílica, os complexos de proteína de detergente são solúveis em soluções aquosas.

figura 12.4
solubilização das proteínas integrais de membrana por detergentes., Detergentes (por exemplo, glucosido octil) são moléculas anfipáticas que contêm grupos hidrofílicos e caudas hidrofóbicas. As caudas hidrofóbicas se ligam às regiões hidrofóbicas da membrana integral (mais…)
muitas proteínas integrais são proteínas transmembranares, que abrangem a camada lipídica com porções expostas em ambos os lados da membrana. Estas proteínas podem ser visualizadas em micrografos de electrões de membranas plasmáticas preparadas pela técnica de freeze-fracture (ver Figura 1.35). Nestes espécimes, a membrana é dividida e separa-se em seus dois folhetos., As proteínas transmembranares são então aparentes como partículas nas faces internas da membrana (figura 12.5).

Figura 12, 5
micro-grafo de electrões de fractura congelada das membranas humanas dos glóbulos vermelhos. As partículas na membrana são proteínas transmembranares. (Harold H. Edwards / Visuals Unlimited.,)
A membrana abrangendo porções de proteínas transmembrana são geralmente α hélices de 20 a 25 hidrofóbico aminoácidos que são inseridas na membrana do retículo endoplasmático, durante a síntese da cadeia polipeptídica (ver Figuras 9.11, 9.12 e 9.13). Estas proteínas são então transportadas em vesículas de membrana do retículo endoplasmático para o aparelho de Golgi, e de lá para a membrana plasmática., Os grupos de hidratos de carbono são adicionados às cadeias de polipéptidos tanto no retículo endoplasmático como no aparelho Golgi, pelo que a maioria das proteínas transmembranares da membrana plasmática são glicoproteínas com os seus oligossacáridos expostos na superfície da célula.estudos efectuados com células vermelhas do sangue forneceram bons exemplos de proteínas periféricas e integrais associadas à membrana plasmática. As membranas dos eritrócitos humanos contêm cerca de uma dúzia de proteínas principais, que foram originalmente identificadas pela eletroforese gel de preparações de membrana., A maioria destas são proteínas de membrana periférica que foram identificadas como componentes do citoesqueleto cortical, que está subjacente à membrana plasmática e determina a forma celular (ver Capítulo 11). Por exemplo, a proteína de membrana periférica mais abundante dos glóbulos vermelhos é a espectrina, que é a principal proteína citoesquelética dos eritrócitos. Outras proteínas da membrana periférica dos glóbulos vermelhos incluem actin, ankirina e Banda 4.1., Anquirina serve como a principal ligação entre a membrana plasmática e o citosqueleto, ligando-se tanto à espectrina como à faixa proteica da membrana integral 3 (ver Figura 11.11). Uma ligação adicional entre a membrana e o citoesqueleto é fornecida pela banda 4.1, que se liga às junções de espectrina e actina, bem como à glicoforina (a outra principal proteína integral da membrana dos eritrócitos).as duas principais proteínas de membrana integral dos glóbulos vermelhos, glicoforina e faixa 3, fornecem exemplos bem estudados de estrutura proteica transmembranar (figura 12.6)., A glicoforina é uma pequena glicoproteína de 131 aminoácidos, com um peso molecular de cerca de 30.000, metade dos quais é proteína e metade carboidrato. A glicoforina atravessa a membrana com uma única hélice de 23 aminoácidos, com a sua porção glicosilada de amino-terminal exposta na superfície celular. Embora a glicoforina tenha sido uma das primeiras proteínas transmembranares a ser caracterizada, a sua função precisa permanece desconhecida. Em contraste, a função da outra principal proteína transmembranar dos glóbulos vermelhos é bem compreendida., Esta proteína, originalmente conhecida como band 3, é o transportador de aniões responsável pela passagem de íons bicarbonato (HCO3-) e cloreto (Cl-) através da membrana dos glóbulos vermelhos. A cadeia polipeptídica da banda 3 é de 929 aminoácidos e acredita-se que tenha 14 regiões α-helicoidais de membrana. Dentro da membrana, os dímeros da faixa 3 formam estruturas globulares contendo canais internos através dos quais os íons são capazes de viajar através do bilayer lipídico.
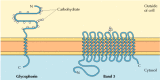
figura 12.6
proteínas integrais da membrana dos glóbulos vermelhos., A glicoforina (131 aminoácidos) contém uma única hélice α transmembranar. É fortemente gliocosilada, com oligossacáridos ligados a 16 locais na porção extracelular da cadeia polipeptídica. (mais…)
devido ao seu carácter anfipático, as proteínas transmembranares revelaram-se difíceis de cristalizar, como exigido para a análise estrutural tridimensional por difração de raios-X., A primeira proteína transmembranar a ser analisada por cristalografia de raios-X foi o centro de reação fotossintética da bactéria Rhodopseudomonas viridis, cuja estrutura foi relatada em 1985 (figura 12.7). O centro de reação contém três proteínas transmembranares, designadas L, M E H (leve, médio e pesado) de acordo com suas dimensões aparentes indicadas pela eletroforese em gel. As subunidades L E M têm cada uma Cinco hélices de membrana. A subunidade H tem apenas uma única hélice α transmembranar, com a maior parte da cadeia polipeptídica no lado citosólico da membrana., A quarta subunidade do centro de reação é um citocromo, que é uma proteína de membrana periférica ligada ao complexo por interações proteína-proteína.

figura 12.7
um centro de reacção fotossintética bacteriana. O centro de reação consiste em três proteínas transmembranares, designadas L (Vermelho), M (amarelo) e H (verde). As subunidades L E M têm cada uma Cinco hélices α transmembranas, enquanto a subunidade H tem apenas (mais…)
embora a maioria das proteínas transmembranares abranja a membrana por regiões α-helicoidais, nem sempre é o caso., Uma exceção bem caracterizada é fornecida pelas porinas—uma classe de proteínas que formam canais nas membranas externas de algumas bactérias. Muitas bactérias, incluindo E. coli, têm um sistema de membrana dupla no qual a membrana plasmática (ou membrana interna) é cercada pela parede celular e uma membrana externa distinta (figura 12.8). Em contraste com a membrana plasmática, a membrana externa é altamente permeável a íons e pequenas moléculas polares (no caso de E. coli, com pesos moleculares até 600). Esta permeabilidade resulta das porinas, que formam canais aquosos abertos através do bicamador lipídico., Como discutido no Capítulo 10, as proteínas relacionadas com as porinas bacterianas também são encontradas nas membranas externas das mitocôndrias e cloroplastos.
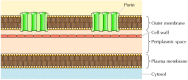
figura 12.8
membranas exteriores bacterianas. A membrana plasmática de algumas bactérias é cercada por uma parede celular e uma membrana externa distinta. A membrana externa contém porinas, que formam canais aquosos abertos, permitindo a passagem livre de íons e pequenas moléculas.
a análise estrutural indicou que as porinas não contêm regiões α-helicoidais hidrofóbicas., Em vez disso, atravessam a membrana em barris β, em que 16 folhas β se dobram numa estrutura semelhante a um barril que envolve um poro aquoso (figura 12.9). As cadeias laterais dos aminoácidos polares lineiam o poro, enquanto as cadeias laterais dos aminoácidos hidrofóbicos interagem com o interior da membrana. Os monómeros de porina associam-se para formar trimers estáveis, cada um dos quais contém três canais abertos através dos quais as moléculas polares podem se difamar através da membrana.

figura 12.9
estrutura de um monómero porin., Cada monómero é um barril β constituído por 16 cordões β antiparalelas (setas). A extremidade superior da molécula enfrenta o meio externo. (From H. Nikaido, 1994. J. Biol. Chem. 269: 3905.)
em contraste com proteínas transmembranares, uma variedade de proteínas (muitas das quais se comportam como proteínas de membrana integral) estão ancoradas na membrana plasmática por lípidos covalentemente ligados ou glicolípidos (figura 12.10). Os membros de uma classe destas proteínas são inseridos no folheto externo da membrana plasmática por âncoras glicosilfosfatidilinositol (GPI)., As âncoras GPI são adicionadas a certas proteínas que foram transferidas para o retículo endoplasmático e estão ancoradas na membrana por uma região transmembranar C-terminal (ver Figura 9.16). A região transmembranar é clivada à medida que a âncora GPI é adicionada, de modo que estas proteínas permanecem ligadas à membrana apenas pelo glicolípido. Uma vez que as cadeias polipeptídicas das proteínas ancoradas em GPI são transferidas para o retículo endoplasmático, são glicosiladas e expostas na superfície da célula após o transporte para a membrana plasmática.
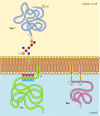
Figura 12.,10
exemplos de proteínas ancoradas na membrana plasmática por lípidos e glicolípidos. Algumas proteínas (por exemplo, a proteína linfocitária Thy-1) estão ancoradas no folheto externo da membrana plasmática por âncoras GPI adicionadas ao seu c terminus no retículo endoplasmático. (mais…)
outras proteínas estão ancoradas no folheto interno da membrana plasmática por lípidos covalentemente ligados. Em vez de serem processadas através da via secreta, estas proteínas são sintetizadas em ribossomas citosólicos livres e depois modificadas pela adição de lípidos., Essas modificações incluem a adição de ácido mirístico (14 de carbono, ácidos graxos) para o amino-terminal da cadeia polipeptídica, a adição de ácido palmítico (16 carbonos), para as cadeias laterais de resíduos de cisteína, e a adição de prenyl (grupos de 15 ou 20 carbonos), para as cadeias laterais de polibutadienos terminal de resíduos de cisteína (ver Figuras 7.29, 7.30 e 7.31). Em alguns casos, estas proteínas (muitas das quais se comportam como proteínas de membrana periférica) são direcionadas para a membrana plasmática por regiões positivamente carregadas da cadeia polipeptídica, bem como pelos lípidos associados., Estes domínios proteicos positivamente carregados podem interagir com os grupos de cabeça negativamente carregados de fosfatidilserina na face citosólica da membrana plasmática. É de notar que muitas das proteínas ancoradas no folheto interno da membrana plasmática (incluindo as proteínas Src e Ras ilustradas na figura 12.10) desempenham papéis importantes na transmissão de Sinais dos receptores da superfície celular para alvos intracelulares, como discutido no próximo capítulo.