resposta longa. Em primeiro lugar, uma distinção deve ser feita entre a polaridade de uma ligação e a polaridade de uma molécula (ou composto). polaridade de ligação refere-se a uma separação da carga elétrica que resulta de uma diferença na eletronegatividade entre os dois átomos ou grupos que se ligam entre si.,
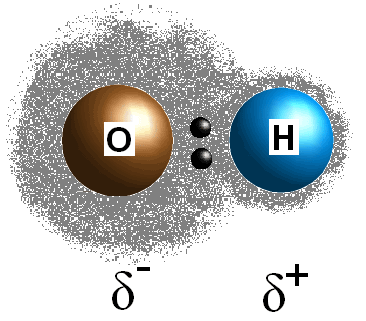
Esta diferença em electronegativity valores entre os dois átomos faz com que o bond elétrons para ser compartilhado de forma desigual, criando, assim, uma carga positiva (#delta^+#) no menos eletronegativos átomo e uma carga parcial negativa (#delta^(-)#) no mais eletronegativos do átomo. A polaridade de uma ligação pode ser determinada usando apenas os valores de eletronegatividade dos dois átomos constituintes. se a ligação entre os dois átomos não é polar, ou seja, a diferença na eletronegatividade entre os dois átomos é inferior a 0.,5, Então sua molécula será não-polar. Se a ligação é realmente polar, você pode prosseguir para tentar determinar a polaridade da molécula.
A geometria de uma molécula é um fator importante na determinação da polaridade de uma molécula. Estas cargas parciais acima mencionadas dão origem a um momento dipolo de bond, #mu#.
Se as orientações destes momentos dipolos de ligação se anularem, então a molécula é dita não-polar. Se no entanto não o fizerem, você está lidando com uma molécula polar.,
Alguns exemplos onde bond momentos de dipolo cancelar-se mutuamente, resultando em uma não-molécula polar:
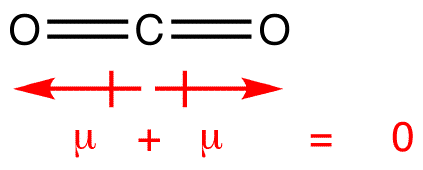
momentos de Dipolo são desenhados com a seta apontando para a mais eletronegativos átomo e o lado positivo em menos eletronegativos átomo. Observe que para #CO_2#, que tem duas ligações polares, o momento dipolar total é zero, uma vez que estas duas setas cancelam uma à outra. Isto resulta numa molécula não polar., O mesmo pode ser dito para #BF_3#:
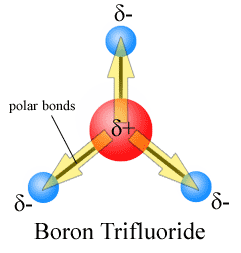
os três momentos dipolares anulam-se um ao outro como resultado da disposição simétrica das ligações (ver mais sobre adição de vetores).
Um assimétrica arranjo das cargas parciais resulta em uma molécula polar, como você pode ver por água:
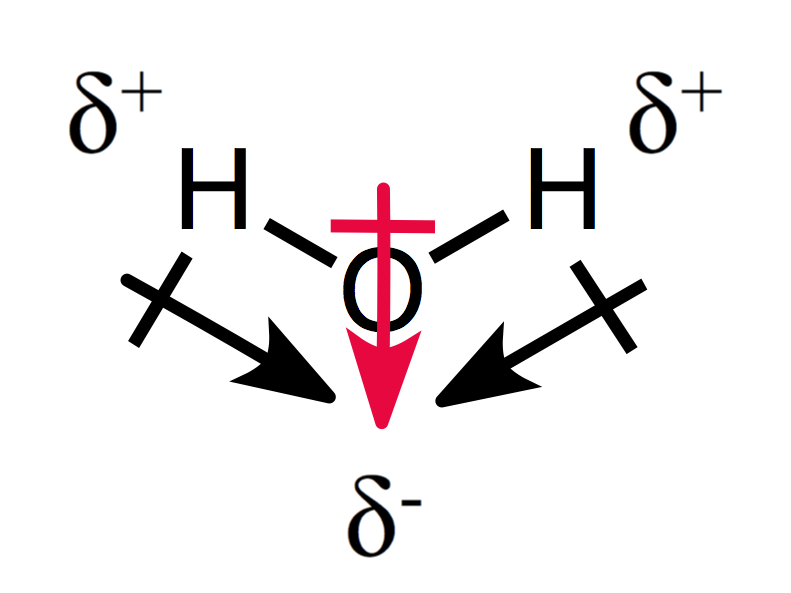
Os dois momentos de dipolo adicionar uns com os outros criando uma geral, momento dipolar, e, portanto, uma molécula polar.,
Como conclusão, a fim de prever a polaridade de uma molécula, você deve estar familiarizado com estruturas de Lewis, eletronegatividade, teoria VSEPR, e polaridade de ligação.