Uma titulação é uma técnica volumétrica em que uma solução de um reagente (a titrant) é adicionada a uma solução de um segundo reagente (o “analito”) até o ponto de equivalência é atingido. O ponto de equivalência é o ponto no qual titrant foi adicionado exatamente na quantidade certa para reagir estoichiometricamente com o analito (quando moles de titrant = moles de analito). Se o titulante ou o analito for colorido, o ponto de equivalência é evidente pelo desaparecimento da cor à medida que os reagentes são consumidos., Caso contrário, pode ser adicionado um indicador que tenha um “endpoint” (muda de cor) no ponto de equivalência, ou o ponto de equivalência pode ser determinado a partir de uma curva de titulação. A quantidade de agregado titrant é determinada a partir de sua concentração e volume:
n (mol) = C (mol/L) * V (L)
e a quantidade de titrant pode ser usado normalmente estequiométrica de cálculo para determinar a quantidade de analito.o processo de titulação pode ser observado no vídeo abaixo.,
um volume medido da solução a titular, neste caso, o ácido acético aquoso incolor, CH3COOH(aq) é colocado num copo. O hidróxido de sódio NaOH(aq) incolor, que é o titular, é adicionado cuidadosamente por meio de um buret. O volume de groselha adicionada pode então ser determinado lendo o nível de líquido no buret antes e depois da titulação. Esta leitura pode normalmente ser estimada até ao centésimo de um mililitro mais próximo, pelo que se pode fazer rapidamente adições precisas de titulante.,
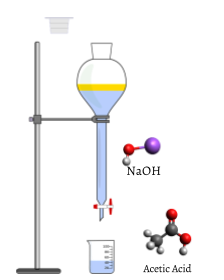
como os primeiros mililitros de fluxo titulante para o frasco, alguns indicadores mudam brevemente para rosa, mas retornam rapidamente para incolor. Isto é devido a um grande excesso de ácido acético. O reagente limitante NaOH é totalmente consumido.o indicador adicionado muda para rosa quando a titulação está completa, indicando que todo o ácido acético aquoso foi consumido por NaOH(aq). A reação que ocorre é
\
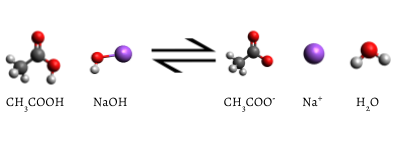
Eventualmente, todo o ácido acético é consumida., A adição de mesmo uma fracção de uma gota de groselha produz uma cor Rosa duradoura devido ao NaOH não reagido no frasco. A mudança de cor que ocorre no ponto final dos sinais indicadores de que todo o ácido acético foi consumido, de modo que chegamos ao ponto de equivalência da titulação. Se um pouco mais de solução de NaOH fosse adicionada, haveria um excesso e a cor da solução no frasco ficaria muito mais escura. O endpoint aparece de repente, e cuidado deve ser tomado para não exceder o endpoint.após a titulação ter atingido o objectivo final, lê-se um volume final a partir do buret., Usando a inicial e final da leitura, o volume adicionado pode ser determinado com bastante precisão:
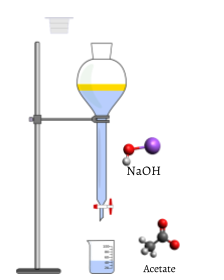
o objecto de uma titulação é sempre adicionar apenas a quantidade de substância titulada necessária para consumir exactamente a quantidade de substância a ser titulada. In the NaOH-CH3COOH reaction Eq. \(\ref{2}\), o ponto de equivalência ocorre quando uma quantidade molar igual de NaOH foi adicionada do cilindro graduado para cada mole de CH3COOH originalmente no frasco de titulação., Ou seja, no ponto de equivalência, a razão da quantidade de NaOH, adicionada à quantidade de CH3COOH consumida, deve igualar a razão estequiométrica
\
titulação é frequentemente utilizada para determinar a concentração de uma solução. Em muitos casos, não é simples obter uma substância pura, pesá-la com precisão e dissolvê-la num balão volumétrico, como foi feito no exemplo 1 de concentrações da solução. NaOH, por exemplo, combina-se rapidamente com H2O e CO2 do ar, e assim mesmo uma amostra recém-preparada de NaOH sólido não será pura., O seu peso mudaria continuamente à medida que o CO2(g) e a H2O(g) fossem absorvidos. Cloreto de hidrogênio (HCl) é um gás a temperaturas e pressões ordinárias, tornando-o muito difícil de manusear ou pesar. As soluções aquosas de ambas as substâncias devem ser padronizadas; ou seja, suas concentrações devem ser determinadas por titulação.
de longe o uso mais comum de titulações é na determinação de incógnitas, ou seja, na determinação da concentração ou quantidade de substância em uma amostra sobre a qual inicialmente não sabíamos nada. O próximo exemplo envolve um desconhecido que muitas pessoas encontram todos os dias.,a 308,0 mg obtida neste exemplo está razoavelmente de acordo com a alegação do fabricante de 300 mg. Os comprimidos são carimbados por máquinas, não pesados individualmente, pelo que se espera alguma variação.