białka błonowe
podczas gdy lipidy są podstawowymi elementami strukturalnymi błon, białka są odpowiedzialne za realizację określonych funkcji błonowych. Większość błon osocza składa się w przybliżeniu z 50% lipidów i 50% białka, a węglowodanowe porcje glikolipidów i glikoprotein stanowią od 5 do 10% masy błon. Ponieważ białka są znacznie większe niż lipidy, procent ten odpowiada około jednej cząsteczki białka na każde 50 do 100 cząsteczek lipidów., W 1972 Jonathan Singer i Garth Nicolson zaproponowali model fluid mosaic struktury membrany, który obecnie jest powszechnie akceptowany jako podstawowy paradygmat organizacji wszystkich błon biologicznych. W tym modelu membrany są postrzegane jako dwuwymiarowe płyny, w których białka są wprowadzane do dwuwarstwowych lipidów (rysunek 12.3).

rysunek 12.3
płynny model mozaiki membrany plazmowej., Integralne białka błonowe są wprowadzane do dwuwarstwowej warstwy lipidowej, podczas gdy białka obwodowe są związane z błoną pośrednio przez interakcje białko-białko. Większość integralnych białek błonowych jest transmembrana (więcej…)
Singer i Nicolson wyróżnili dwie klasy białek błonowych, które nazwali obwodowymi i integralnymi białkami błonowymi., Białka błon obwodowych zostały operacyjnie zdefiniowane jako białka, które dysocjują z błony po zabiegach z odczynnikami polarnymi, takimi jak roztwory o ekstremalnym pH lub wysokim stężeniu soli, które nie zakłócają dwuwarstwy fosfolipidowej. Po oddzieleniu od błony, białka błon obwodowych są rozpuszczalne w buforach wodnych. Białka te nie są wprowadzane do hydrofobowego wnętrza dwuwarstwy lipidowej. Zamiast tego są one pośrednio związane z błonami poprzez interakcje białko-białko., Interakcje te często obejmują wiązania jonowe, które są zakłócane przez ekstremalne pH lub wysoką sól.
w przeciwieństwie do obwodowych białek błonowych, integralne białka błonowe mogą być uwalniane tylko przez zabiegi, które zakłócają dwuwarstwę fosfolipidową. Części tych integralnych białek błonowych są wprowadzane do dwuwarstwy lipidowej, więc mogą być dysocjowane tylko przez odczynniki, które zakłócają interakcje hydrofobowe., Najczęściej stosowanymi odczynnikami do rozpuszczania integralnych białek błonowych są detergenty, które są małymi cząsteczkami amfipatycznymi zawierającymi zarówno grupy hydrofobowe, jak i hydrofilowe (rysunek 12.4). Hydrofobowe części detergentów wypierają lipidy membranowe i wiążą się z hydrofobowymi częściami integralnych białek membranowych. Ponieważ drugi koniec cząsteczki detergentu jest hydrofilowy, kompleksy detergentowo-białkowe są rozpuszczalne w roztworach wodnych.

rysunek 12.4
rozpuszczanie integralnych białek błonowych za pomocą detergentów., Detergenty (np. glukozyd oktylu) są cząsteczkami amfipatycznymi zawierającymi hydrofilowe grupy głowic i hydrofobowe ogony. Ogony hydrofobowe wiążą się z obszarami hydrofobowymi błony integralnej (więcej…)
wiele białek integralnych jest białkami transmembranowymi, które obejmują dwuwarstwę lipidową z częściami odsłoniętymi po obu stronach błony. Białka te mogą być wizualizowane w mikrografach elektronowych błon osocza przygotowanych techniką freeze-fracture (patrz rysunek 1.35). U tych okazów błona jest rozszczepiona i rozdziela się na Dwie listki., Białka Transmembrane są następnie widoczne jako cząstki na wewnętrznych powierzchniach błony (rysunek 12.5).

rysunek 12.5
Freeze-fractionalgraph elektronowy błon czerwonych krwinek. Cząsteczki w błonie są białkami transmembranowymi. (Harold H. Edwards / Visuals Unlimited.,)
części obejmujące błonę białek transmembranowych są zwykle α helisami od 20 do 25 hydrofobowych aminokwasów, które są wprowadzane do błony retikulum endoplazmatycznego podczas syntezy łańcucha polipeptydowego (patrz rysunki 9.11, 9.12 i 9.13). Białka te są następnie transportowane w pęcherzykach błonowych z retikulum endoplazmatycznego do aparatu Golgiego, a stamtąd do błony plazmatycznej., Grupy węglowodanowe są dodawane do łańcuchów polipeptydowych zarówno w retikulum endoplazmatycznym, jak i aparacie Golgiego, więc większość transmembranowych białek błony plazmatycznej to glikoproteiny z ich oligosacharydami odsłoniętymi na powierzchni komórki.
badania czerwonych krwinek dostarczyły dobrych przykładów zarówno obwodowych, jak i integralnych białek związanych z błoną osocza. Błony ludzkich erytrocytów zawierają około tuzina głównych białek, które zostały pierwotnie zidentyfikowane przez elektroforezę żelową preparatów membranowych., Większość z nich to białka błon obwodowych, które zostały zidentyfikowane jako składniki cytoszkieletu korowego, leżącego u podstaw błony plazmatycznej i determinującego kształt komórki (patrz rozdział 11). Na przykład, najbardziej obfite białko błony obwodowej czerwonych krwinek jest spectrin, który jest głównym cytoszkieletowym białkiem erytrocytów. Inne białka błony obwodowej krwinek czerwonych obejmują aktynę, ankyrinę i pasmo 4.1., Ankyrina służy jako główne ogniwo między błoną osocza a cytoszkieletem poprzez wiązanie zarówno spectryny, jak i integralnego pasma białka błony 3 (patrz rysunek 11.11). Dodatkowe połączenie między błoną a cytoszkieletem zapewnia pasmo 4.1, które wiąże się z połączeniami spektryny i aktyny, a także z glikoforyną (inne główne integralne białko błonowe erytrocytów).
dwa główne integralne białka błonowe krwinek czerwonych, glikoforyna i pasmo 3, dostarczają dobrze zbadanych przykładów struktury białek transmembranowych (rysunek 12.6)., Glikoforyna jest małą glikoproteiną 131 aminokwasów, o masie cząsteczkowej około 30 000, z których połowa to białko, a połowa węglowodany. Glikoforyna przecina błonę pojedynczą helisą α obejmującą 23 aminokwasy, z jej glikozylowaną aminokwasową częścią końcową odsłoniętą na powierzchni komórki. Chociaż glikoforyna była jednym z pierwszych białek transmembranowych, które zostały scharakteryzowane, jej dokładna funkcja pozostaje nieznana. Natomiast funkcja innych głównych białek transmembranowych krwinek czerwonych jest dobrze poznana., Białko to, pierwotnie znane jako band 3, jest transporterem anionów odpowiedzialnym za przejście jonów wodorowęglanu (HCO3-) i chlorku (CL-) przez błonę czerwonych krwinek. Łańcuch polipeptydowy pasma 3 to 929 aminokwasów i uważa się, że ma 14 obszarów α-helical obejmujących błonę. W obrębie membrany dimery pasma 3 tworzą struktury kuliste zawierające kanały wewnętrzne, przez które jony są w stanie podróżować przez dwuwarstwę lipidową.
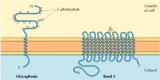
rysunek 12.6
integralne białka błonowe krwinek czerwonych., Glikoforyna (131 aminokwasów) zawiera pojedynczą transmembranową helisę α. Jest silnie glikozylowany, z oligosacharydami przyłączonymi do 16 miejsc na pozakomórkowej części łańcucha polipeptydowego. (więcej…)
ze względu na swój amfipatyczny charakter białka transmembrane okazały się trudne do krystalizacji, co jest wymagane do trójwymiarowej analizy strukturalnej za pomocą dyfrakcji rentgenowskiej., Pierwszy transmembrane białko analizowane przez krystalografii rentgenowskiej był centrum reakcji fotosyntetycznej bakterii Rhodopseudomonas viridis, którego struktura została opisana w 1985 (rysunek 12.7). Centrum reakcji zawiera trzy białka transmembrane, oznaczone L, M I H (lekkie, średnie i ciężkie) zgodnie z ich pozornymi rozmiarami wskazanymi przez elektroforezę żelową. Podjednostki L I M mają po pięć Helis α rozciągających się na błonie. Podjednostka H ma tylko jedną helisę transmembranową α, z większą częścią łańcucha polipeptydowego po cytozolowej stronie błony., Czwartą podjednostką centrum reakcji jest cytochrom, który jest białkiem błony obwodowej związanym z kompleksem w wyniku interakcji białko-białko.

rysunek 12.7
bakteryjne centrum reakcji fotosyntetycznych. Centrum reakcji składa się z trzech białek transmembranowych, oznaczonych L( Czerwony), M (żółty) i H (zielony). Podjednostki L I M mają po pięć Helis transmembranowych α, podczas gdy podjednostka H ma tylko (więcej…)
chociaż większość białek transmembranowych obejmuje błonę regionami α-helicznymi, nie zawsze tak jest., Dobrze scharakteryzowany wyjątek stanowią poryny—Klasa białek, które tworzą kanały w zewnętrznych błonach niektórych bakterii. Wiele bakterii, w tym E. coli, ma podwójny system membranowy, w którym błona osocza (lub błona wewnętrzna) jest otoczona ścianą komórkową i wyraźną błoną zewnętrzną (rysunek 12.8). W przeciwieństwie do błony plazmatycznej, błona zewnętrzna jest wysoce przepuszczalna dla jonów i małych cząsteczek polarnych(w przypadku E. coli, o masie cząsteczkowej do 600). Ta przepuszczalność wynika z poryn, które tworzą otwarte kanały wodne przez dwuwarstwę lipidową., Jak omówiono w rozdziale 10, białka związane z bakteryjnymi porynami znajdują się również w zewnętrznych błonach mitochondriów i chloroplastów.
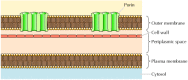
rysunek 12.8
bakteryjne błony zewnętrzne. Błona osocza niektórych bakterii otoczona jest ścianą komórkową i wyraźną błoną zewnętrzną. Błona zewnętrzna zawiera poryny, które tworzą otwarte kanały wodne umożliwiające swobodny przepływ jonów i małych cząsteczek.
Analiza strukturalna wykazała, że poryny nie zawierają hydrofobowych regionów α-helicznych., Zamiast tego przechodzą przez membranę jako beczki β, w których 16 arkuszy β składa się w strukturę przypominającą beczkę, otaczającą wodną porę (rysunek 12.9). Łańcuchy boczne aminokwasów polarnych wyrównują pory, podczas gdy łańcuchy boczne aminokwasów hydrofobowych oddziałują z wnętrzem błony. Monomery porynowe łączą się tworząc stabilne trymery, z których każdy zawiera trzy otwarte kanały, przez które polarne cząsteczki mogą dyfundować przez membranę.

rysunek 12.9
struktura monomeru porynowego., Każdy monomer jest beczką β składającą się z 16 antyparalelnych wiązek β (strzałek). Górny koniec cząsteczki zwrócony jest ku zewnętrznemu medium. (Z H. Nikaido, 1994. J. Biol. Chem. 269: 3905.)
w przeciwieństwie do białek transmembranowych, różne białka (z których wiele zachowuje się jak integralne białka błonowe) są zakotwiczone w błonie osocza przez kowalencyjnie przyłączone lipidy lub glikolipidy (rysunek 12.10). Członkowie jednej z klas tych białek są wprowadzani do zewnętrznej błony osocza przez kotwy glikozylofosfatydyloinozytolu (GPI)., Kotwy GPI są dodawane do niektórych białek, które zostały przeniesione do retikulum endoplazmatycznego i są zakotwiczone w błonie przez C-końcowy region transmembrany (patrz rysunek 9.16). Obszar transmembrany jest rozcinany, gdy Kotwica GPI jest dodawana, więc białka te pozostają przyłączone do błony tylko przez glikolipid. Ponieważ łańcuchy polipeptydowe białek zakotwiczonych w GPI są przenoszone do retikulum endoplazmatycznego, są glikozylowane i narażone na powierzchni komórki po transporcie do błony plazmatycznej.
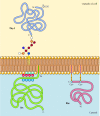
Rysunek 12.,10
przykłady białek zakotwiczonych w błonie osocza przez lipidy i glikolipidy. Niektóre białka (np. białko limfocytów Thy-1) są zakotwiczone w zewnętrznej ulotce błony osocza przez kotwy GPI dodane do ich końca C w retikulum endoplazmatycznym. (więcej…)
inne białka są zakotwiczone w wewnętrznej błonie osocza przez kowalencyjnie przyłączone lipidy. Białka te, zamiast być przetwarzane przez szlak wydzielniczy, są syntetyzowane na wolnych cytozolowych rybosomach, a następnie modyfikowane przez dodanie lipidów., Modyfikacje te obejmują dodanie kwasu mirystynowego (14-węglowego kwasu tłuszczowego) do aminowego końca łańcucha polipeptydowego, dodanie kwasu palmitynowego (16 węgli) do łańcuchów bocznych reszt cysteiny oraz dodanie grup prenylowych (15 lub 20 węgli) do łańcuchów bocznych karboksy-końcowych reszt cysteiny (patrz rysunki 7.29, 7.30 i 7.31). W niektórych przypadkach białka te (z których wiele zachowuje się jak białka błon obwodowych) są kierowane do błony osocza przez pozytywnie naładowane regiony łańcucha polipeptydowego, jak również przez dołączone lipidy., Te dodatnio naładowane domeny białkowe mogą oddziaływać z ujemnie naładowanymi grupami głowowymi fosfatydyloseryny na cytozolowej powierzchni błony plazmatycznej. Warto zauważyć, że wiele białek zakotwiczonych w wewnętrznej ulotce błony osocza (w tym białka Src i Ras zilustrowane na rysunku 12.10) odgrywają ważną rolę w przekazywaniu sygnałów z receptorów powierzchniowych komórek do celów wewnątrzkomórkowych, jak omówiono w następnym rozdziale.