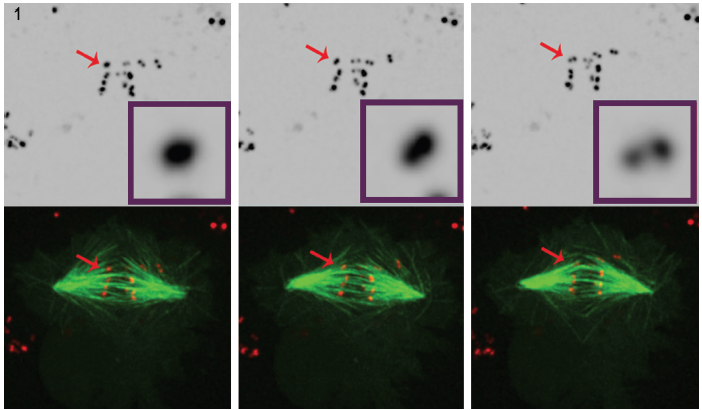
Rysunek 1. Trzy wybrane zdjęcia z filmu o komórkach zubożonych w POLO wyraźnie pokazują, że z czasem intensywny sygnał centromeru / kinetochoru (czerwony) rozpuszcza się w parę kropek, co pokazuje, że chromosomy są syntelicznie przyłączone do mikrotubul wrzeciona (zielony). Zbiory danych mikroskopii fluorescencyjnej 4D były zbierane co 30 sekund z 0.,5-milimetrowe stopnie z obejmujące całą objętość komórki przy użyciu obiektywu plan-apochromatycznego 100°, 1,4 NA w temperaturze 25°C z konfokalną jednostką Revolution spinning disk i kamerą IXON EMCCD, oba napędzane przez oprogramowanie Andor IQ live-cell imaging.
podział komórek mitotycznych polega na zdolności komórek do prawidłowego rozmieszczenia chromatyd siostrzanych w komórki tworzące. Aby niezawodnie wykonywać tę funkcję, komórki wykorzystują wewnętrzne mechanizmy edycyjne, aby skorygować niedokładne przyłączenie włókien chromosomu / wrzeciona., Sparowane kinetochory są zwykle wyrównane, aby prawidłowo dołączyć włókna wrzeciona i segregować chromatynę, jednak błędne i niewspółosiowe kinetochory powodują. Komórki zawierają wyspecjalizowane mechanizmy edycyjne zapobiegające i korygujące te niewspółosiowe pary kinetochorów, chociaż dokładny mechanizm nie jest dobrze poznany 1,2 ., Tatiana Moutinho-Santos z Universidade do Porto, portugalskiego Instituto de Biologia Molecular e Celular (IBMC) postuluje, że obecność kinazy POLO jest konieczna do promowania orientacji chromosomowej (określanej jako układ amfiteliczny), a tym samym zachowania odpowiedniego wyrównania kinetochor.
aby lepiej zrozumieć jego rolę w regulacji rozwoju kinetochor, Dr Moutinho dos Santos badał zubożoną kinazę Drosophila POLO w żywych komórkach, aby udowodnić zaangażowanie POLO w funkcje edycyjne wymagane do utrzymania układu kinetochor amfitelicznych., W tym przypadku badano układ synteliczny (kinetochory siostrzane przyłączone do mikrotubul pochodzących z tego samego wrzeciona). Analizę czasoprzestrzenną mitozy przeprowadzono na komórkach Drosophila S2 o stabilnej ekspresji CID-mCherry dla wizualizacji centromerów i GFP-a-tubuliny dla mikrotubul. Wizualizacja kinetochorów jest wymagająca ze względu na ich niewielkie rozmiary, niski sygnał fluorescencyjny i krótki wygląd podczas podziału komórki. Konfokalna mikroskopia fluorescencyjna jest często używana do obrazowania kinetochorów, jednak nawet w tym środowisku wizualizacja pozostaje trudna., Kinetochory są bardzo małe (300 nm)3, zbliżone do bocznych zdolności rozdzielczych mikroskopu świetlnego i przekraczają jego osiową zdolność rozdzielczą. Ponadto obrazowanie fluorescencyjnych markerów w żywych komórkach stwarza potencjalne efekty fototoksyczne i fotobleaching. Intensywne oświetlenie laserowe może powodować problemy fototoksyczne, szczególnie szkodliwe dla żywych, dzielących się komórek.
Andor ' s Revolution XD spinning disk confocal microscopy jest wykorzystywany do przezwyciężenia wyjątkowego wyzwania Dr Moutinho dos Santo, związanego z obserwacją kinetochorów., W tym przypadku, cztery oddzielne czynniki muszą być adresowane jednocześnie odpowiednio wizualizować dynamiczne procesy komórkowe:
- szybkość akwizycji
- przestrzenne i czasowe zdolności rozdzielcze
- zdolność do wykrywania bardzo niskich poziomów intensywności fluorescencji
- Zarządzanie dostępnym sygnałem fluorescencyjnym
te tematy przestrzennej, czasowej i intensywności rozdzielczości powtarzają się często w mikroskopii fluorescencyjnej i są często sprzeczne z eksperymentami obejmującymi obserwację żywotności komórek., Na przykład długie ekspozycje z aparatu i wydłużone okresy intensywnego oświetlenia generują efekty fototoksyczne, które uszkadzają lub niszczą żywe komórki. Jednocześnie lekko oznakowane mikrostruktury wymagają dłuższej ekspozycji na wizualizację, ale mogą być niekorzystnie wpływane przez fotobleaching. Problemem jest konieczność połączenia tradycyjnych danych trójwymiarowych z danymi czasu. Wreszcie, konieczne pozostaje rozróżnienie sygnału od szumu tła i zamglenia outof-focus.
szybkość akwizycji ma szczególne znaczenie dla Dr Mountinho dos Santos., Komórki kontrolne S2 wykazują cykl podziału wynoszący około 30 minut. Jednak zużyte komórki S2 POLO wykorzystane w jej eksperymentach wykazały okres zatrzymania przekraczający osiem godzin. Rejestrowanie podziałów komórek POLO wymaga zbierania od 7200 do 12 000 zestawów obrazów (dwa fluorochromy obrazowane co trzydzieści sekund przez jedną do pięciu godzin, uzyskiwane w krokach osiowych 0,5 mikrona z maksymalnie 20 krokami dla rozdzielczości kinetochor osiowych)., Konwencjonalna mikroskopia fluorescencyjna i oświetlenie laserowe nie pozwoli na delikatne wymagania oświetleniowe konieczne ani szybkość nabywania do wykonania tego wrażliwego na czas zadania. Na przykład rasterowanie laserowe w tradycyjnej mikroskopii konfokalnej wymaga dłuższych okresów czasu na zbieranie sygnału z próbki. Spinning disk confocal systems są używane do przezwyciężenia tych tradycyjnych barier i ujawnienia nowych wglądów w kinetochore molekularnych technik edycji.,
w porównaniu do konwencjonalnych systemów fluorescencji szerokokątnej rozdzielczość przestrzenna wirującego dysku konfokalnego jest lepsza zarówno w wymiarach bocznych (x i y), jak i osiowych (z). Dzięki ciągłemu skanowaniu matrycy otworkowej próbki mogą być oglądane w czasie rzeczywistym z wysokim kontrastem, zapewniając wyraźne obrazy na granicy dyfrakcji optyki mikroskopu. Umożliwia to Wizualizację 3D i zrozumienie dynamicznego zachowania kinetochoru w odniesieniu do mikrotubul wrzeciona., Kinetochore i centromere boczna rozdzielczość 300nm i wrzeciona rozdzielczość włókien 300-500 nm zostały zgłoszone i są szczegółowe na rysunku A.
rozdzielczość intensywności
Wizualizacja fluorescencyjnie oznakowanych kinetochorów związanych z każdym centromerem stawia dodatkowe wymagania wobec systemu akwizycji. Badane centromery i kinetochory są widoczne przede wszystkim podczas międzyfazy podziału komórek. Gdy komórki przechodzą przez prophase, centromery już rozdzielają się w typowe dla Drosophila dwanaście par chromosomów., Zarządzanie dostępnym budżetem światła podczas długotrwałego akwizycji wymaga delikatnego oświetlenia i wysokiej rozdzielczości zdolnej do technik wirowania dysku. Otwory w wirującej jednostce dyskowej zapewniają te korzyści. Ponieważ światło wzbudza fluorophores tylko wtedy, gdy apertura jest obecny, efekty fototoksyczne są zminimalizowane. Choć przeciwstawny, zmniejszony budżet światła nie wskazuje słabych, trudnych do wykrycia obiektów. Rozdzielczość intensywności jest zwiększana poprzez wykluczenie z dysku obrotowego sygnału nieostrego i późniejsze wzmocnienie sygnału przez architekturę kamery EMCCD., Stwarza to nową możliwość generowania obrazów o wyższym kontraście, ujawniających rozwój i wyrównanie punktowych obiektów, takich jak kinetochory.
wnioski
Zastosowanie technologii spinning disk w aplikacji Dr. Mountinho dos Santos live cell doprowadziło do ważnej obserwacji. W przypadku braku kinazy POLO wykazano, że komórki Drosophila nie posiadają mechanizmów korekcyjnych niezbędnych do utrzymania amfitelicznego układu chromosomów., Wykazano, że obecność POLO zapewnia odpowiednie środowisko dla prawidłowej architektury centromeru, przy jednoczesnym zapewnieniu właściwej orientacji chromosomów. Hodowane komórki Drosophila poddawane mitozie przy braku chromosomów kinazy POLO przyłączają się do włókien wrzeciona o orientacji syntelicznej, tj. z siostrzanymi kinetochorami przyłączonymi do mikrotubul, które pochodzą z pojedynczego bieguna wrzeciona.
wniosek ten został wyciągnięty przez dokładną analizę mikroskopii fluorescencyjnej 4D w komórkach wyrażających fluorescencyjnie znakowany marker centromeru / kinetochoru i mikrotubule. (Rysunek 1).