cele nauki
pod koniec tej sekcji będziesz mógł:
- opisać, w jaki sposób elektrony zostały odkryte.
- wyjaśnij eksperyment kropli oleju.
- opisz eksperyment z złotą folią.
- opisz model planetarny atomu.
podobnie jak atomy są podbudową materii, elektrony i jądra są podbudową atomu., Eksperymenty, które zostały wykorzystane do odkrycia elektronów i jąder ujawniają niektóre z podstawowych właściwości atomów i mogą być łatwo zrozumiane za pomocą idei, takich jak siła elektrostatyczna i magnetyczna, już omówione w poprzednich rozdziałach.
ładunki i siły elektromagnetyczne
w poprzednich dyskusjach zauważyliśmy, że ładunek dodatni jest związany z jądrami, a ładunek ujemny z elektronami. Omówiliśmy również wiele aspektów sił elektrycznych i magnetycznych, które wpływają na ładunki., Zbadamy teraz odkrycie elektronu i jądra jako podstaw atomu i zbadamy ich wkład w właściwości atomów.
Elektron

Rysunek 1. Rura wyładowcza gazu świeci, gdy przyłożone jest do niej wysokie napięcie. Elektrony emitowane z katody są przyspieszane w kierunku anody; pobudzają atomy i cząsteczki w gazie, które świecą w odpowiedzi., Kiedyś nazywane lampami Geisslera, a później lampami Crookesa, są obecnie znane jako lampy elektronopromieniowe (CRT) i znajdują się w starszych telewizorach, ekranach komputerowych i urządzeniach rentgenowskich. Po przyłożeniu pola magnetycznego wiązka wygina się w kierunku oczekiwanym dla ładunku ujemnego. (źródło: Paul Downey, Flickr)
rury wyładowcze, takie jak pokazane na rysunku 1, składają się z ewakuowanej szklanej rury zawierającej dwie metalowe elektrody i rozrzedzony Gaz. Po przyłożeniu wysokiego napięcia do elektrod, Gaz świeci. Lampy te były prekursorami dzisiejszych neonów., Zostały one po raz pierwszy badane poważnie przez Heinricha Geisslera, niemiecki wynalazca i dmuchawy szkła, począwszy od 1860 roku. angielski naukowiec William Crookes, między innymi, kontynuował badania, co przez pewien czas były nazywane lampy Crookesa, w którym elektrony są uwolnione od atomów i cząsteczek w rozrzedzonym gazie wewnątrz rury i są przyspieszane z katody (ujemne) do anody (dodatnie) przez wysoki potencjał., Te „promienie katodowe” zderzają się z atomami i cząsteczkami gazu i pobudzają je, powodując emisję promieniowania elektromagnetycznego (EM), które sprawia, że ścieżka elektronów jest widoczna jako promień, który rozprzestrzenia się i zanika, gdy oddala się od katody.
lampy wyładowcze są dziś najczęściej nazywane lampami katodowymi, ponieważ promienie pochodzą z katody. Crookes wykazał, że elektrony przenoszą pęd (mogą obracać się małe koło łopatkowe)., Odkrył również, że ich normalnie prosta droga jest wygięta przez magnes w kierunku oczekiwanym dla ujemnego ładunku odchodzącego od katody. Były to pierwsze bezpośrednie wskazania elektronów i ich ładunku.

Rysunek 2. J. J. Thomson (credit: www.firstworldwar.com, via Wikimedia Commons)
angielski fizyk J. J. Thomson (1856-1940) udoskonalił i rozszerzył zakres eksperymentów z rurkami wyładowczymi. (Patrz rysunek 2 i Rysunek 3.,) Zweryfikował ujemny ładunek promieni katodowych zarówno polami magnetycznymi, jak i elektrycznymi. Dodatkowo zebrał promienie w metalowym kubku i znalazł nadmiar ładunku ujemnego. Thomson był również w stanie zmierzyć stosunek ładunku elektronu do jego masy, \frac{q_e}{m_e}\\—ważny krok do znalezienia rzeczywistych wartości zarówno qe, jak i me. Rysunek 4 przedstawia lampę elektronopromieniową, która wytwarza wąską wiązkę elektronów, która przechodzi przez płyty ładujące połączone z zasilaczem wysokiego napięcia., Pole elektryczne E jest wytwarzane między płytkami ładującymi, a lampa elektronopromieniowa jest umieszczona między biegunami magnesu tak, że pole elektryczne E jest prostopadłe do pola magnetycznego B magnesu. Pola te, będąc prostopadłe do siebie, wytwarzają przeciwstawne siły na elektrony. Jak opisano w przypadku spektrometrów mas w większej liczbie zastosowań magnetyzmu, jeśli siła netto spowodowana polami znika, to prędkość naładowanej cząstki wynosi v= \ frac{E} {B}\\., W ten sposób Thomson określał prędkość elektronów, a następnie przesuwał wiązkę w górę i w dół, regulując pole elektryczne.

Rysunek 3. Schemat CRT Thomsona. (credit: Kurzon, Wikimedia Commons)

Rysunek 4. Ten schemat pokazuje wiązkę elektronów w CRT przechodzącą przez skrzyżowane pola elektryczne i magnetyczne i powodując świecenie fosforu podczas uderzania w koniec rury.
zbieramy terminy, mamy \frac{q_e}{m_e}=\frac{A}{E}\\.,
Co jest tak ważnego w \frac{q_e}{m_e}\\, stosunku ładunku elektronu do jego masy? Otrzymana wartość to
\displaystyle \ frac{q_e}{m_e}=-1.76 \ times10^{11}\text{ C/kg (elektron)}\\
jest to ogromna liczba, jak zauważył Thomson, i oznacza to, że elektron ma bardzo małą masę. Wiadomo było z galwanizacji, że około 108 C / kg jest potrzebne do płyty materiału, współczynnik około 1000 mniej niż ładunek na kilogram elektronów., Thomson kontynuował ten sam eksperyment dla dodatnio naładowanych jonów wodorowych (obecnie znanych jako gołe protony) i odkrył ładunek na kilogram około 1000 razy mniejszy niż dla elektronu, co sugeruje, że proton jest około 1000 razy masywniejszy niż elektron. Dziś wiemy dokładniej, że
\displaystyle\frac{q_p}{M_P}=9.58\times10^{7}\text{ C/kg (proton)}\\,
gdzie qp jest ładunkiem protonu, a mp jego masą. Stosunek ten (do czterech cyfr znaczących) wynosi 1836 razy mniej ładunku na kilogram niż dla elektronu., Ponieważ ładunki elektronów i protonów są równe pod względem wielkości, oznacza to mp = 1836me.
Thomson przeprowadził szereg eksperymentów, wykorzystując różne gazy w rurkach wyładowczych i stosując inne metody, takie jak efekt fotoelektryczny, do uwalniania elektronów z atomów. Zawsze odnajdywał te same właściwości dla elektronu, udowadniając, że jest on niezależną cząstką. Za swoją pracę, której ważne prace zaczął publikować w 1897 roku, Thomson otrzymał w 1906 roku Nagrodę Nobla w dziedzinie fizyki., Z perspektywy czasu trudno jest docenić, jak zdumiewające było odkrycie, że atom ma podbudowę. Sam Thomson powiedział: „dopiero kiedy byłem przekonany, że eksperyment nie pozostawił ucieczki, opublikowałem moją wiarę w istnienie ciał mniejszych od atomów.”
Thomson próbował zmierzyć ładunek pojedynczych elektronów, ale jego metoda mogła określić jego ładunek tylko do oczekiwanego rzędu wielkości.
od czasu eksperymentów Faradaya z galwanizacją w 1830 roku, wiadomo było, że około 100 000 C na MOL jest potrzebne do płytkowania pojedynczo zjonizowanych jonów., Dzieląc to przez liczbę jonów Na mol (czyli przez liczbę Avogadro), która była w przybliżeniu znana, ładunek na jon obliczono na około 1,6 × 10-19 C, zbliżony do rzeczywistej wartości.

Rysunek 5. Robert Millikan (Źródło: Nieznany Autor, Wikimedia Commons)
amerykański fizyk, Robert Millikan (1868-1953) (patrz rysunek 5), postanowił ulepszyć eksperyment Thomsona do pomiaru qe i ostatecznie został zmuszony do wypróbowania innego podejścia, które jest teraz klasycznym eksperymentem wykonywanym przez studentów., Eksperyment kropli oleju Millikana pokazano na rysunku 6.
w eksperymencie Millikan oil drop, drobne krople oleju są rozpylane z rozpylacza. Niektóre z nich są ładowane przez proces, a następnie mogą być zawieszone między metalowymi płytami przez napięcie między płytami. W tej sytuacji ciężar spadku jest równoważony siłą elektryczną:
m dropg = qe E

Rysunek 6., Eksperyment Millikan oil drop dał pierwszy dokładny bezpośredni pomiar ładunku elektronów, jednej z najbardziej fundamentalnych stałych w przyrodzie. Drobne krople oleju ładują się po rozpyleniu. Ich ruch jest obserwowany pomiędzy metalowymi płytami o potencjale przyłożonym do przeciwstawienia się sile grawitacji. Równowaga sił grawitacyjnych i elektrycznych umożliwia obliczenie ładunku na kropli. Ładunek jest kwantyzowany w jednostkach -1,6 × 10-19 C, określając w ten sposób bezpośrednio ładunek nadmiaru i brakujących elektronów na kroplach oleju.,
pole elektryczne jest wytwarzane przez przyłożone napięcie, stąd E= \ frac{V} {d}\\, A V jest ustawione tak, aby zrównoważyć ciężar spadku. Krople mogą być postrzegane jako punkty odbitego światła za pomocą mikroskopu, ale są zbyt małe, aby bezpośrednio zmierzyć ich rozmiar i masę. Masę kropli określa się obserwując, jak szybko spada po wyłączeniu napięcia. Ponieważ opór powietrza jest bardzo znaczący dla tych submikroskopowych kropli, bardziej masywne krople spadają szybciej niż mniej masywne, a zaawansowane obliczenia sedymentacyjne mogą ujawnić ich masę., Olej jest używany zamiast wody, ponieważ nie łatwo paruje, a więc masa jest prawie stała. Gdy masa kropli jest znana, ładunek elektronu jest podawany przez przestawianie poprzedniego równania:
\displaystyle{q}=\frac{m_{\text{drop}}g}{E}=\frac{M_{\text{drop}}gd}{V}\\,
gdzie d jest rozdzieleniem płyt, A V jest napięciem utrzymującym kroplę nieruchomo. (Ta sama kropla może być obserwowana przez kilka godzin, aby zobaczyć, że naprawdę jest nieruchoma.,) W 1913 roku Millikan zmierzył ładunek elektronu qe z dokładnością do 1% i poprawił to o współczynnik 10 w ciągu kilku lat do wartości -1,60 × 10-19 C. zauważył również, że wszystkie ładunki były wielokrotnościami podstawowego ładunku elektronu i że nagłe zmiany mogą wystąpić, w których elektrony zostały dodane lub usunięte z kropli. Za ten bardzo fundamentalny bezpośredni pomiar qe i za badania efektu fotoelektrycznego, Millikan otrzymał w 1923 roku Nagrodę Nobla w dziedzinie fizyki.,
przy znanym ładunku elektronu i znanym stosunku ładunku do masy można obliczyć masę elektronu. Jest to
\displaystyle{m}=\frac{q_e}{\left(\frac{q_e}{m_e}\right)}\\
zastępowanie znanych wartości daje
\displaystyle{m}_e=\frac{-1.60\times10^{-19}\text{ C}}{-1.76\times10^{11}\text{ C/kg}}\\
lub Me = 9.11 × 10-31 kg (masa elektronu), gdzie błędy zaokrągleń zostały poprawione., Masa elektronu została zweryfikowana w wielu późniejszych eksperymentach i jest obecnie znana z dokładnością lepszą niż jedna część na milion. Jest to niezwykle mała masa i pozostaje najmniejszą znaną masą każdej cząstki, która ma masę. (Niektóre cząstki, takie jak fotony, są bezmasowe i nie mogą spoczywać, ale poruszają się z prędkością światła.) Podobne obliczenia podają masy innych cząstek, w tym protonu. Do trzech cyfr masa protonu jest obecnie znana jako mp = 1,67 × 10-27 kg (masa protonu), która jest prawie identyczna z masą atomu wodoru., To, co zrobili Thomson i Millikan, było udowodnieniem istnienia jednej podbudowy atomów, elektronu, a następnie wykazaniem, że miała ona tylko niewielki ułamek masy atomu. Jądro atomu zawiera większość swojej masy, a natura jądra była całkowicie nieprzewidywalna.
zaczęła się też pojawiać kolejna ważna cecha mechaniki kwantowej. Wszystkie elektrony są identyczne ze sobą. Ładunek i masa elektronów nie są wartościami średnimi; są raczej unikalnymi wartościami, które mają wszystkie elektrony., Dotyczy to innych podstawowych podmiotów na poziomie submikroskopowym. Wszystkie protony są identyczne ze sobą, i tak dalej.
jądro
tutaj badamy pierwsze bezpośrednie dowody wielkości i masy jądra. W kolejnych rozdziałach przyjrzymy się wielu innym aspektom fizyki jądrowej, ale podstawowe informacje na temat wielkości i masy jądra atomowego są tak ważne dla zrozumienia atomu, że rozważamy je tutaj.
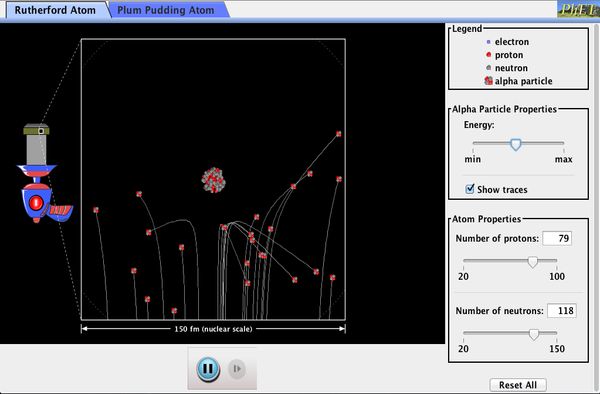
radioaktywność jądrowa została odkryta w 1896 roku i wkrótce stała się przedmiotem intensywnych badań wielu najlepszych naukowców na świecie., Wśród nich był Nowozelandczyk Lord Ernest Rutherford, który dokonał wielu fundamentalnych odkryć i zdobył tytuł ” ojca fizyki jądrowej.”Urodzony w Nelson, Rutherford odbył studia podyplomowe w Cavendish Laboratories w Anglii, zanim podjął pracę na McGill University w Kanadzie, gdzie wykonał pracę, która przyniosła mu Nagrodę Nobla w dziedzinie chemii w 1908 roku. W dziedzinie fizyki atomowej i jądrowej istnieje wiele nakładania się chemii i fizyki, a fizyka dostarcza podstawowych teorii wspomagających., W późniejszych latach powrócił do Anglii i miał sześciu przyszłych Noblistów jako studentów. Rutherford użył promieniowania jądrowego do bezpośredniego zbadania wielkości i masy jądra atomowego. Eksperyment, który wymyślił, pokazano na rysunku 7. Radioaktywne źródło, które emituje promieniowanie alfa został umieszczony w pojemniku ołowiu z otworem w jednej stronie do produkcji wiązki cząstek alfa, które są rodzajem promieniowania jonizującego wyrzucane przez jądra źródła radioaktywnego., Cienka złota folia została umieszczona w wiązce, a rozpraszanie cząstek alfa było obserwowane przez poświatę, którą spowodowały, gdy uderzyły w ekran fosforowy.

Rysunek 5. Eksperyment Rutherforda dał bezpośrednie dowody na rozmiar i masę jądra poprzez rozpraszanie cząstek alfa z cienkiej złotej folii. Cząstki alfa o energiach około 5MeV są emitowane ze źródła radioaktywnego (który jest małym metalowym pojemnikiem, w którym określona ilość materiału radioaktywnego jest zamknięta), są kolimowane w wiązkę i spadają na folię., Liczba cząstek, które przenikają przez folię lub rozpraszają się pod różnymi kątami, wskazuje, że jądra złota są bardzo małe i zawierają prawie całą masę atomu złota. Na to szczególnie wskazują cząstki alfa, które rozpraszają się pod bardzo dużymi kątami, podobnie jak piłka odbijająca się od głowy bramkarza.,cząstki alfa były znane jako podwójnie naładowane dodatnie jądra atomów helu, które miały energię kinetyczną rzędu 5 MeV, gdy były emitowane w rozpadie jądrowym, który jest rozpadem jądra niestabilnego nuklidu przez spontaniczną emisję naładowanych cząstek. Cząstki te oddziałują z materią głównie poprzez siłę Coulomba, a sposób, w jaki rozpraszają się od jąder, może ujawnić rozmiar i masę jądrową. Jest to analogiczne do obserwowania, jak kula do kręgli jest rozproszona przez obiekt, którego nie widać bezpośrednio., Ponieważ energia cząstki alfa jest tak duża w porównaniu z typowymi energiami związanymi z atomami (MeV kontra eV), można oczekiwać, że cząstki alfa po prostu rozbiją się przez cienką folię, podobnie jak naddźwiękowa kula do kręgli rozbije się przez kilkadziesiąt rzędów kręgli. Thomson przewidywał, że atom będzie małą sferą, w której równomiernie rozłożone są równe ilości ładunku dodatniego i ujemnego. Padające masywne cząstki alfa uległyby jedynie niewielkim ugięciom w takim modelu., Zamiast tego Rutherford i jego współpracownicy odkryli, że cząstki alfa czasami były rozproszone pod dużymi kątami, niektóre nawet w kierunku, z którego przybyły! Szczegółowa analiza przy użyciu zachowania pędu i energii-szczególnie małej liczby, która przyszła prosto z powrotem-sugerowała, że jądra złota są bardzo małe w porównaniu z wielkością atomu złota, zawierają prawie całą masę atomu i są ściśle związane. Ponieważ jądro złota jest kilka razy masywniejsze niż cząstka Alfa, zderzenie czołowe rozproszy cząstkę Alfa prosto w kierunku źródła., Ponadto, im mniejsze jądro, tym mniej cząstek alfa, które uderzyłyby w jedną głowę.
chociaż wyniki eksperymentu zostały opublikowane przez jego kolegów w 1909 roku, Rutherfordowi zajęło dwa lata, aby przekonać się o ich znaczeniu. Podobnie jak Thomson przed nim, Rutherford był niechętny do zaakceptowania tak radykalnych wyników. Przyroda na małą skalę jest tak odmienna od naszego klasycznego świata, że nawet ci, którzy są na czele odkryć, są czasami zaskoczeni. Rutherford napisał później: „to było prawie tak niesamowite, jak gdybyś wystrzelił 15-calowy pocisk w kawałek bibułki i wrócił i uderzył cię., Po namyśle, zdałem sobie sprawę, że to rozprasza się do tyłu . . . . . . największa część masy atomu była skoncentrowana w maleńkim jądrze.”
w 1911 Rutherford opublikował swoją analizę wraz z proponowanym modelem atomu. Rozmiar jądra ustalono na około 10-15 m, czyli 100 000 razy mniejszy od atomu. Oznacza to ogromną gęstość, rzędu 1015 g / cm3, znacznie różniącą się od jakiejkolwiek materii makroskopowej. Sugerowane jest również istnienie nieznanych wcześniej sił jądrowych, które przeciwdziałają ogromnym odpychającym siłom Coulomba wśród ładunków dodatnich w jądrze., Ogromne siły byłyby również zgodne z dużymi energiami emitowanymi w promieniowaniu jądrowym.

Rysunek 8. Rozszerzony widok atomów w złotej folii w eksperymencie Rutherforda. Okręgi reprezentują Atomy (około 10-10 m średnicy), podczas gdy kropki reprezentują jądra (około 10-15 m średnicy). Aby być widocznym, kropki są znacznie większe niż skala. Większość cząstek alfa rozbija się, ale są stosunkowo nienaruszone ze względu na ich wysoką energię i małą masę elektronu., Niektóre jednak kierują się prosto w stronę jądra i są rozproszone prosto do tyłu. Szczegółowa analiza podaje wielkość i masę jądra.
mały rozmiar jądra oznacza również, że atom jest w większości pusty wewnątrz. W rzeczywistości, w eksperymencie Rutherforda, większość Alf przeszła prosto przez złotą folię z bardzo małym rozpraszaniem, ponieważ elektrony mają tak małe masy i ponieważ atom był w większości pusty, a alfa nie mogła trafić., Pojawiły się na ten temat już w czasie, gdy Rutherford przeprowadzał swoje eksperymenty, ponieważ zaobserwowano, że elektrony energetyczne przenikają cienkie folie łatwiej niż się spodziewano. Rysunek 8 przedstawia schemat atomów w cienkiej folii z kółkami reprezentującymi rozmiar atomów (około 10-10 m) i kropkami reprezentującymi jądra. (Kropki nie są do skalowania—gdyby były, potrzebowałbyś mikroskopu, aby je zobaczyć.) Większość cząstek alfa brakuje małych jąder i są tylko nieznacznie rozproszone przez elektrony., Czasami (około raz na 8000 razy w eksperymencie Rutherforda) Alfa uderza w jądro i jest rozproszona prosto do tyłu.

Rysunek 9. Planetarny model atomu Rutherforda zawiera cechy jądra, elektronów i wielkości atomu. Model ten był pierwszym, który rozpoznał strukturę atomów, w których elektrony o niskiej masie krążą po bardzo małym, masywnym jądrze na orbitach znacznie większych od jądra. Atom jest w większości pusty i jest analogiczny do naszego układu planetarnego.,
bazując na wielkości i masie jądra ujawnionego w swoim eksperymencie, a także masie elektronów, Rutherford zaproponował planetarny model atomu. Model planetarny atomu przedstawia elektrony o niskiej masie krążące wokół jądra o dużej masie. Rozmiary orbitali elektronów są duże w porównaniu z wielkością jądra, z głównie próżnią wewnątrz atomu. Obraz ten jest analogiczny do tego, jak planety o małej masie w naszym Układzie Słonecznym okrążają słońce o dużej masie w odległościach większych niż wielkość słońca., W atomie Siła przyciągania Coulomba jest analogiczna do grawitacji w układzie planetarnym. (Patrz Rysunek 9.) Zauważ, że model lub obraz mentalny jest potrzebny do wyjaśnienia wyników eksperymentu, ponieważ atom jest zbyt mały, aby można go było bezpośrednio obserwować za pomocą światła widzialnego.
planetarny model atomu Rutherforda miał kluczowe znaczenie dla zrozumienia właściwości atomów, ich oddziaływań i energii, co zobaczymy w kilku następnych sekcjach. Było to również wskazanie na to, jak różna jest natura od znanego klasycznego świata w małej, kwantowo mechanicznej skali., Odkrycie podbudowy dla całej materii w postaci atomów i cząsteczek było teraz podejmowane o krok dalej, aby ujawnić podbudowę atomów, która była prostsza niż 92 pierwiastki wtedy znane. Kontynuowaliśmy poszukiwania głębszych struktur, takich jak te wewnątrz jądra, z pewnym sukcesem. W kolejnych rozdziałach będziemy śledzić to poszukiwanie w dyskusji o kwarkach i innych cząstkach elementarnych i przyjrzymy się, w jakim kierunku wydaje się teraz zmierzać poszukiwanie.,
jak Rutherford odkrył strukturę atomu nie będąc w stanie go zobaczyć? Symulacja słynnego eksperymentu, w którym obalił model atomu puddingu śliwkowego, obserwując cząstki alfa odbijające się od atomów i stwierdzając, że muszą one mieć mały rdzeń.
Kliknij, aby pobrać symulację. Uruchom za pomocą Javy.,

Kliknij, aby pobrać symulację. Uruchom za pomocą Javy.,
podsumowanie sekcji
problemy& ćwiczenia
- Jaka byłaby ta gęstość dla złota?
- w eksperymencie z kroplą oleju Millikana patrzy się na małą kroplę oleju trzymaną nieruchomo między dwiema płytami. Weź napięcie między płytami na 2033 V, A separację płyt na 2,00 cm. Kropla oleju (o gęstości 0,81 g/cm3) ma średnicę 4,0 × 10-6 m. Znajdź ładunek na kropli, pod względem jednostek elektronów.,
- (a) początkująca fizyk chce zbudować model skali atomu wodoru dla swojego projektu science fair. Jeśli atom ma średnicę 1,00 m, to jak duża powinna próbować zrobić jądro? b) jak łatwo będzie to zrobić?