miareczkowanie jest techniką objętościową, w której roztwór jednego reaktora (titrant) dodaje się do roztworu drugiego reaktora („analit”) aż do osiągnięcia punktu równoważności. Punkt równoważności jest punktem, w którym titrant został dodany w dokładnie odpowiedniej ilości, aby reagować stechiometrycznie z analytenem (gdy Mole titrantu = Mole analitu). Jeśli titrant lub analit jest barwiony, punkt równoważności jest widoczny z zaniku koloru, gdy reagenty są zużywane., W przeciwnym razie można dodać wskaźnik, który ma „punkt końcowy” (zmienia kolor) w punkcie równoważności, lub punkt równoważności można wyznaczyć na podstawie krzywej miareczkowania. Ilość dodanego titrantu określa się na podstawie jego stężenia i objętości:
n (mol) = C (mol/L) * V (l)
i ilość titrantu można wykorzystać w zwykłych obliczeniach stechiometrycznych do określenia ilości analitu.
proces miareczkowania można zaobserwować na poniższym filmie.,
zmierzona objętość roztworu, który ma być miareczkowany, w tym przypadku bezbarwny wodny kwas octowy, CH3COOH(AQ) umieszcza się w zlewce. Bezbarwny wodorotlenek sodu NaOH (aq), który jest titrantem, dodaje się ostrożnie za pomocą biuret. Objętość dodanego titrantu można następnie określić poprzez odczytanie poziomu cieczy w biuście przed i po miareczkowaniu. Odczyt ten można zwykle oszacować do najbliższej setnej mililitra, dzięki czemu precyzyjne dodawanie titranta można szybko wykonać.,
gdy kilka pierwszych mililitrów titranta wpływa do kolby, niektóre wskaźniki na krótko zmieniają kolor na różowy, ale szybko wracają do bezbarwnego. Wynika to z dużego nadmiaru kwasu octowego. Odczynnik ograniczający NaOH jest całkowicie zużyty.
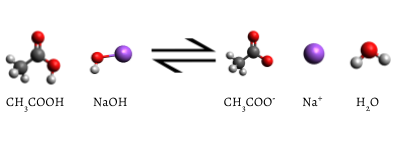
dodany wskaźnik zmienia kolor na różowy po zakończeniu miareczkowania, co wskazuje, że cały wodny kwas octowy został zużyty przez NaOH(aq). Reakcja, która zachodzi to
\
ostatecznie zużywany jest cały kwas octowy., Dodatek nawet ułamka kropli titranta daje trwały różowy kolor z powodu nieodwracalnego NaOH w kolbie. Zmiana koloru, która występuje w punkcie końcowym wskaźnika, sygnalizuje, że cały kwas octowy został zużyty, więc osiągnęliśmy punkt równoważności miareczkowania. Gdyby dodać nieco więcej roztworu NaOH, byłby nadmiar, a kolor roztworu w kolbie stałby się znacznie ciemniejszy. Punkt końcowy pojawia się nagle i należy zachować ostrożność, aby nie przekroczyć punktu końcowego.
Po osiągnięciu punktu końcowego miareczkowania odczytuje się końcową objętość z biuret., Korzystając z odczytu początkowego i końcowego, dodaną objętość można określić dość precyzyjnie:
celem miareczkowania jest zawsze dodanie tylko ilości titranta potrzebnej do spożycia dokładnie takiej ilości miareczkowanej substancji. W reakcji NaOH-CH3COOH Eq. \(\ref{2}\), punkt równoważności występuje, gdy równa ilość molowa NaOH została dodana z cylindra miareczkowego dla każdego mola CH3COOH pierwotnie w kolbie miareczkowej., Oznacza to, że w punkcie równoważności stosunek ilości NaOH dodanego do ilości CH3COOH zużywanego musi być równy stosunkowi stechiometrycznemu
\
miareczkowanie jest często używane do określenia stężenia roztworu. W wielu przypadkach uzyskanie czystej substancji, dokładne zważenie jej i rozpuszczenie w kolbie miarowej nie jest prostą sprawą, jak to miało miejsce w przykładzie 1 stężeń roztworu. NaOH, na przykład, szybko łączy się z H2O i CO2 z powietrza, a więc nawet świeżo przygotowana próbka stałego NaOH nie będzie czysta., Jego masa zmieniałaby się w sposób ciągły, gdy pochłaniano CO2 (g) i H2O (g). Chlorowodór (HCl) jest gazem w zwykłych temperaturach i ciśnieniach, co sprawia, że jest bardzo trudny w obsłudze lub ważeniu. Wodne roztwory obu tych substancji muszą być standaryzowane; to znaczy, ich stężenia muszą być określone przez miareczkowanie.
zdecydowanie najczęstszym zastosowaniem miareczkowania jest określanie niewiadomych, czyli określanie stężenia lub ilości substancji w próbce, o której początkowo nic nie wiedzieliśmy. Następny przykład dotyczy nieznanego, z którym wiele osób spotyka się każdego dnia.,
308,0 mg uzyskane w tym przykładzie jest w dość ścisłej zgodności z twierdzeniem producenta 300 mg. Tabletki są wytłaczane przez maszyny, a nie ważone pojedynczo, dlatego oczekuje się pewnych zmian.