Lernziele
Am Ende dieses Abschnitts können Sie:
- Beschreiben, wie Elektronen entdeckt wurden.
- Erklären Sie das Millikan – Öltropfen-Experiment.
- Beschreiben Sie Rutherfords Goldfolienexperiment.
- Beschreibe Rutherfords Planetenmodell des Atoms.
So wie Atome eine Unterstruktur der Materie sind, sind Elektronen und Kerne Unterstrukturen des Atoms., Die Experimente, mit denen Elektronen und Kerne entdeckt wurden, zeigen einige der grundlegenden Eigenschaften von Atomen und können leicht mit Ideen wie elektrostatischer und magnetischer Kraft verstanden werden, die bereits in früheren Kapiteln behandelt wurden.
Ladungen und elektromagnetische Kräfte
In früheren Diskussionen haben wir festgestellt, dass positive Ladung mit Kernen und negative Ladung mit Elektronen verbunden ist. Wir haben auch viele Aspekte der elektrischen und magnetischen Kräfte behandelt, die Ladungen beeinflussen., Wir werden nun die Entdeckung des Elektrons und des Kerns als Unterstrukturen des Atoms untersuchen und ihre Beiträge zu den Eigenschaften von Atomen untersuchen.
Das Elektron

Abbildung 1. Eine Gasentladungsröhre leuchtet, wenn eine hohe Spannung an sie angelegt wird. Elektronen, die von der Kathode emittiert werden, werden zur Anode hin beschleunigt; Sie erregen Atome und Moleküle im Gas, die als Reaktion leuchten., Einst Geissler-Röhren und später Crookes-Röhren genannt, sind sie heute als Kathodenstrahlröhren (CRTs) bekannt und finden sich in älteren Fernsehern, Computerbildschirmen und Röntgengeräten. Wenn ein Magnetfeld angelegt wird, biegt sich der Strahl in die Richtung, die für eine negative Ladung erwartet wird. (kredit: Paul Downey, Flickr)
Gasentladungsrohre, wie in Abbildung 1 gezeigt, bestehen aus einem evakuierten Glasrohr mit zwei Metallelektroden und einem verdünnten Gas. Wenn eine hohe Spannung an die Elektroden angelegt wird, leuchtet das Gas. Diese Röhren waren die Vorläufer der heutigen Neonlichter., Sie wurden zunächst ernsthaft von Heinrich Geissler, einem deutschen Erfinder und Glasbläser, ab den 1860er Jahren untersucht. Der englische Wissenschaftler William Crookes, unter anderem, weiterhin zu untersuchen, was für einige Zeit wurden Crookes Rohre genannt, wobei Elektronen von Atomen und Molekülen in dem verdünnten Gas im Inneren der Röhre befreit und von der Kathode (negativ) an die Anode (positiv) durch das hohe Potential beschleunigt., Diese „Kathodenstrahlen“ kollidieren mit den Gasatomen und-molekülen und erregen sie, was zur Emission elektromagnetischer (EM) Strahlung führt, die den Weg der Elektronen als Strahl sichtbar macht, der sich ausbreitet und verblasst, wenn er sich von der Kathode entfernt.
Gasentladungsröhren werden heute am häufigsten als Kathodenstrahlröhren bezeichnet, da die Strahlen an der Kathode entstehen. Crookes zeigte, dass die Elektronen einen Impuls tragen (sie können ein kleines Schaufelrad drehen lassen)., Er fand auch heraus, dass ihr normalerweise gerader Weg von einem Magneten in die Richtung gebogen wird, die für eine negative Ladung erwartet wird, die sich von der Kathode wegbewegt. Dies waren die ersten direkten Hinweise auf Elektronen und ihre Ladung.

Abbildung 2. J. J. Thomson (Kredit: www.firstworldwar.com, via Wikimedia Commons)
Der englische Physiker J. J. Thomson (1856-1940) verbessert und erweitert den Umfang von Experimenten mit gasentladungsröhren. (Siehe Abbildung 2 und Abbildung 3.,) Verifizierte er die negative Ladung der Kathodenstrahlen sowohl mit magnetischen als auch mit elektrischen Feldern. Zusätzlich sammelte er die Strahlen in einem Metallbecher und fand einen Überschuss an negativer Ladung. Thomson konnte auch das Verhältnis der Ladung des Elektrons zu seiner Masse messen, \ frac{q_e}{m_e}\\—ein wichtiger Schritt, um die tatsächlichen Werte von qe und me zu finden. Abbildung 4 zeigt eine Kathodenstrahlröhre, die einen schmalen Elektronenstrahl erzeugt, der durch Ladungsplatten verläuft, die an eine Hochspannungsstromversorgung angeschlossen sind., Zwischen den Ladeplatten wird ein elektrisches Feld E erzeugt, und die Kathodenstrahlröhre wird zwischen die Pole eines Magneten gelegt, so dass das elektrische Feld E senkrecht zum Magnetfeld B des Magneten steht. Diese Felder, die senkrecht zueinander stehen, erzeugen entgegengesetzte Kräfte auf die Elektronen. Wie für Massenspektrometer in mehr Anwendungen des Magnetismus diskutiert, wenn die Nettokraft aufgrund der Felder verschwindet, dann ist die Geschwindigkeit des geladenen Teilchens v= \ frac{E}{B}\\., Auf diese Weise bestimmte Thomson die Geschwindigkeit der Elektronen und bewegte dann den Strahl durch Einstellen des elektrischen Feldes auf und ab.

Abbildung 3. Diagramm von Thomsons CRT. (credit: Kurzon, Wikimedia Commons)

Abbildung 4. Dieses Schema zeigt den Elektronenstrahl in einem CRT, der durch gekreuzte elektrische und magnetische Felder geht und Phosphor zum Leuchten bringt, wenn er auf das Ende der Röhre trifft.
Sammeln Begriffe, die wir haben, \frac{q_e}{m_e}=\frac{a}{E}\\.,
Was ist so wichtig an\ frac{q_e}{m_e}\\, dem Verhältnis der Ladung des Elektrons zu seiner Masse? Der erhaltene Wert ist
\displaystyle\frac{q_e}{m_e}=-1.76\times10^{11}\text{ C/kg (Elektron)}\\
Dies ist eine große Zahl, wie Thomson realisierte, und es impliziert, dass das Elektron eine sehr kleine Masse hat. Aus der Galvanik war bekannt, dass etwa 108 C/kg zur Platte eines Materials benötigt werden, ein Faktor von etwa 1000 weniger als die Ladung pro Kilogramm Elektronen., Thomson führte das gleiche Experiment für positiv geladene Wasserstoffionen (jetzt bekannt als nackte Protonen) durch und fand eine Ladung pro Kilogramm, die etwa 1000 Mal kleiner war als die für das Elektron, was bedeutet, dass das Proton etwa 1000 mal massiver ist als das Elektron. Heute wissen wir genauer, dass
\displaystyle\frac{q_p}{m_p}=9.58\times10^{7}\text{ C/kg (proton)}\\,
wo qp ist die Ladung des Protons und der mp ist seine Masse. Dieses Verhältnis (zu vier signifikanten Zahlen) ist 1836 mal weniger Ladung pro Kilogramm als für das Elektron., Da die Ladungen von Elektronen und Protonen gleich groß sind, impliziert dies mp = 1836me.
Thomson führte eine Vielzahl von Experimenten mit unterschiedlichen Gasen in Entladungsröhren durch und verwendete andere Methoden, wie den photoelektrischen Effekt, um Elektronen von Atomen zu befreien. Er fand immer die gleichen Eigenschaften für das Elektron und bewies, dass es ein unabhängiges Teilchen ist. Für seine Arbeit, deren wichtige Stücke er 1897 zu veröffentlichen begann, erhielt Thomson 1906 den Nobelpreis für Physik., Im Nachhinein ist es schwer zu begreifen, wie erstaunlich es war, dass das Atom eine Unterstruktur hat. Thomson selbst sagte: „Erst als ich überzeugt war, dass das Experiment keinen Ausweg daraus ließ, veröffentlichte ich meinen Glauben an die Existenz von Körpern, die kleiner als Atome sind.“
Thomson versuchte, die Ladung einzelner Elektronen zu messen, aber seine Methode konnte ihre Ladung nur in der erwarteten Größenordnung bestimmen.
Seit Faradays Experimenten mit der Galvanik in den 1830er Jahren war bekannt, dass etwa 100.000 C pro Mol zur Platte einzeln ionisierter Ionen benötigt wurden., Dividiert man dies durch die Anzahl der Ionen pro Mol (dh durch die Anzahl von Avogadro), die ungefähr bekannt war, wurde die Ladung pro Ion auf etwa 1,6 × 10-19 C nahe dem tatsächlichen Wert berechnet.

Abbildung 5. Robert Millikan (Kredit: Unbekannter Autor, über Wikimedia Commons)
Ein amerikanischer Physiker, Robert Millikan (1868-1953) (siehe Abbildung 5), beschlossen, Thomsons Experiment zur Messung von qe zu verbessern und wurde schließlich gezwungen, einen anderen Ansatz zu versuchen, das ist jetzt ein klassisches Experiment von Studenten durchgeführt., Das Millikan-Öltropfen-Experiment ist in Abbildung 6 dargestellt.
Im Millikan oil drop Experiment werden feine Öltropfen aus einem Zerstäuber gesprüht. Einige von ihnen werden durch den Prozess aufgeladen und können dann zwischen Metallplatten durch eine Spannung zwischen den Platten aufgehängt werden. In dieser Situation wird das Gewicht des Tropfens durch die elektrische Kraft ausgeglichen:
m dropg = qe E

Abbildung 6., Das Millikan-Öltropfen-Experiment produzierte die erste genaue direkte Messung der Ladung auf Elektronen, eine der grundlegendsten Konstanten in der Natur. Feine Tropfen Öl werden beim Sprühen aufgeladen. Ihre Bewegung wird zwischen Metallplatten mit einem Potential beobachtet, das der Gravitationskraft entgegengesetzt ist. Das Gleichgewicht von Gravitations-und elektrischen Kräften ermöglicht die Berechnung der Ladung auf einem Tropfen. Es wird festgestellt, dass die Ladung in Einheiten von -1,6 × 10-19 C quantisiert wird, wodurch die Ladung der überschüssigen und fehlenden Elektronen auf den Öltropfen direkt bestimmt wird.,
Das elektrische Feld wird durch die angelegte Spannung erzeugt, daher E= \ frac{V}{d}\\, und V wird angepasst, um nur das Gewicht des Tropfens auszugleichen. Die Tropfen können mit einem Mikroskop als reflektierte Lichtpunkte gesehen werden, sind jedoch zu klein, um ihre Größe und Masse direkt zu messen. Die Masse des Tropfens wird bestimmt, indem beobachtet wird, wie schnell er fällt, wenn die Spannung ausgeschaltet wird. Da der Luftwiderstand für diese submikroskopischen Tropfen sehr bedeutsam ist, fallen die massiveren Tropfen schneller als die weniger massiven, und ausgeklügelte Sedimentationsberechnungen können ihre Masse aufdecken., Öl wird anstelle von Wasser verwendet, da es nicht leicht verdunstet und daher die Masse nahezu konstant ist. Sobald die Masse des Tropfens bekannt ist, wird die Ladung des Elektrons gegeben, indem die vorherige Gleichung neu angeordnet wird:
\displaystyle{q}=\frac{m_{\text{drop}}g}{E}=\frac{m_{\text{drop}}gd}{V}\\,
wobei d die Trennung der Platten ist und V die Spannung ist, die den Tropfen bewegungslos hält. (Derselbe Tropfen kann mehrere Stunden beobachtet werden, um zu sehen, dass er wirklich bewegungslos ist.,) Bis 1913 hatte Millikan die Ladung des Elektrons qe mit einer Genauigkeit von 1% gemessen, und er verbesserte diese um den Faktor 10 innerhalb weniger Jahre auf einen Wert von -1.60 × 10-19 C. Er beobachtete auch, dass alle Ladungen ein Vielfaches der Grundelektronenladung waren und dass plötzliche Veränderungen auftreten konnten, bei denen Elektronen hinzugefügt oder aus den Tropfen entfernt wurden. Für diese sehr grundlegende direkte Messung von qe und für seine Studien des photoelektrischen Effekts wurde Millikan 1923 mit dem Nobelpreis für Physik ausgezeichnet.,
Mit der Ladung des bekannten Elektrons und dem bekannten Ladungs-zu-Masse-Verhältnis kann die Masse des Elektrons berechnet werden. Es ist
\displaystyle{m}=\frac{q_e}{\left(\frac{q_e}{m_e}\right)}\\
Ersetzen bekannten Werten ergibt
\displaystyle{m}_e=\frac{-1.60\times10^{-19}\text{ C}}{-1.76\times10^{11}\text{ C/kg}}\\
me = 9.11 × 10-31 kg (electron ‚ s mass), wo die Rundungsfehler korrigiert wurden., Die Masse des Elektrons wurde in vielen nachfolgenden Experimenten verifiziert und ist nun mit einer Genauigkeit von mehr als einem Teil von einer Million bekannt. Es ist eine unglaublich kleine Masse und bleibt die kleinste bekannte Masse eines Partikels, das Masse hat. (Einige Teilchen, wie Photonen, sind massenlos und können nicht zur Ruhe gebracht werden, sondern bewegen sich mit Lichtgeschwindigkeit.) Eine ähnliche Berechnung ergibt die Massen anderer Teilchen, einschließlich des Protons. Es ist nun bekannt, dass die Masse des Protons dreistellig mp = 1,67 × 10-27 kg (Protonenmasse) ist, was fast identisch mit der Masse eines Wasserstoffatoms ist., Was Thomson und Millikan getan hatten, war, die Existenz einer Unterstruktur von Atomen, des Elektrons, zu beweisen und weiter zu zeigen, dass es nur einen winzigen Bruchteil der Masse eines Atoms hatte. Der Kern eines Atoms enthält den größten Teil seiner Masse, und die Natur des Kerns war völlig unerwartet.
Ein weiteres wichtiges Merkmal der Quantenmechanik begann ebenfalls zu entstehen. Alle Elektronen sind identisch miteinander. Die Ladung und Masse der Elektronen sind keine Durchschnittswerte, sondern eindeutige Werte, die alle Elektronen haben., Dies gilt für andere grundlegende Entitäten auf submikroskopischer Ebene. Alle Protonen sind identisch miteinander und so weiter.
Der Kern
Hier untersuchen wir den ersten direkten Beweis für die Größe und Masse des Kerns. In späteren Kapiteln werden wir viele andere Aspekte der Kernphysik untersuchen, aber die grundlegenden Informationen über Kerngröße und-masse sind für das Verständnis des Atoms so wichtig, dass wir es hier betrachten.
Die nukleare Radioaktivität wurde 1896 entdeckt und war bald Gegenstand intensiver Studien einiger der besten Wissenschaftler der Welt., Unter ihnen war der Neuseeländer Lord Ernest Rutherford, der zahlreiche grundlegende Entdeckungen machte und den Titel „Vater der Kernphysik“ erhielt.= = Leben = = Rutherford studierte zunächst an den Cavendish Laboratories in England, bevor er 1908 an der McGill University in Kanada einen Nobelpreis für Chemie erhielt. Im Bereich der Atom-und Kernphysik gibt es große Überschneidungen zwischen Chemie und Physik, wobei die Physik die grundlegenden Fördertheorien liefert., Er kehrte in späteren Jahren nach England zurück und hatte sechs zukünftige Nobelpreisträger als Studenten. Rutherford verwendete Kernstrahlung, um die Größe und Masse des Atomkerns direkt zu untersuchen. Das von ihm entwickelte Experiment ist in Abbildung 7 dargestellt. Eine radioaktive Quelle, die Alpha-Strahlung emittiert, wurde in einen Bleibehälter mit einem Loch auf einer Seite gelegt, um einen Strahl von Alphateilchen zu erzeugen, bei denen es sich um eine Art ionisierender Strahlung handelt, die von den Kernen einer radioaktiven Quelle ausgestoßen wird., Eine dünne Goldfolie wurde in den Strahl gelegt, und die Streuung der Alphateilchen wurde durch das Leuchten beobachtet, das sie verursachten, als sie auf ein Phosphorsieb trafen.

Abbildung 5. Rutherfords Experiment gab direkten Beweis für die Größe und Masse des Kerns durch Streuung von Alphateilchen aus einer dünnen Goldfolie. Alphateilchen mit Energien von etwa 5MeV werden von einer radioaktiven Quelle emittiert (einem kleinen Metallbehälter, in dem eine bestimmte Menge eines radioaktiven Materials versiegelt ist), werden zu einem Strahl kollimiert und fallen auf die Folie., Die Anzahl der Partikel, die in die Folie eindringen oder in verschiedene Winkel streuen, zeigt an, dass Goldkerne sehr klein sind und fast die gesamte Masse des Goldatoms enthalten. Dies wird insbesondere durch die Alphateilchen angezeigt, die sich in sehr große Winkel streuen, ähnlich wie ein Fußball, der vom Kopf eines Torhüters abprallt.,
Es war bekannt, dass Alphateilchen die doppelt geladenen positiven Kerne von Heliumatomen waren, die kinetische Energien in der Größenordnung von 5 MeV aufwiesen, wenn sie im nuklearen Zerfall emittiert wurden, was der Zerfall des Kerns eines instabilen Nuklids durch die spontane Emission geladener Teilchen ist. Diese Teilchen interagieren meist über die Coulomb-Kraft mit Materie, und die Art und Weise, wie sie aus Kernen streuen, kann Kerngröße und-masse offenbaren. Dies ist analog zu beobachten, wie eine Bowlingkugel von einem Objekt verstreut wird, das Sie nicht direkt sehen können., Da die Energie des Alphateilchens im Vergleich zu den typischen Energien, die mit Atomen assoziiert sind (MeV versus eV), so groß ist, würden Sie erwarten, dass die Alphateilchen einfach durch eine dünne Folie abstürzen, ähnlich wie eine Überschall-Bowlingkugel durch ein paar Dutzend Reihen von Bowlingstiften abstürzen würde. Thomson hatte sich das Atom als eine kleine Kugel vorgestellt, in der gleiche Mengen positiver und negativer Ladung gleichmäßig verteilt waren. Die einfallenden massiven Alphateilchen würden bei einem solchen Modell nur geringe Ablenkungen erleiden., Stattdessen stellten Rutherford und seine Mitarbeiter fest, dass Alphateilchen gelegentlich in große Winkel verstreut waren, einige sogar in die Richtung, aus der sie kamen! Eine detaillierte Analyse unter Verwendung von Impulserhaltung und Energie—insbesondere der kleinen Zahl, die gerade zurückkam—implizierte, dass Goldkerne im Vergleich zur Größe eines Goldatoms sehr klein sind, fast die gesamte Masse des Atoms enthalten und fest gebunden sind. Da der Goldkern um ein Vielfaches massiver ist als das Alphateilchen, würde eine Frontalkollision das Alphateilchen direkt zurück zur Quelle streuen., Je kleiner der Kern ist, desto weniger Alphateilchen würden einen Kopf treffen.
Obwohl die Ergebnisse des Experiments 1909 von seinen Kollegen veröffentlicht wurden, brauchte Rutherford zwei Jahre, um sich von ihrer Bedeutung zu überzeugen. Wie Thomson vor ihm zögerte Rutherford, solche radikalen Ergebnisse zu akzeptieren. Die Natur im kleinen Maßstab ist so anders als unsere klassische Welt, dass selbst diejenigen, die an der Spitze der Entdeckung stehen, manchmal überrascht sind. Rutherford schrieb später: „Es war fast so unglaublich, als hättest du eine 15-Zoll-Granate auf ein Stück Seidenpapier abgefeuert und es kam zurück und traf dich., Bei der Betrachtung, erkannte ich, dass diese Streuung nach hinten . . . . . . der größte Teil der Masse des Atoms war in einem winzigen Kern konzentriert.“
1911 veröffentlichte Rutherford seine Analyse zusammen mit einem vorgeschlagenen Modell des Atoms. Die Größe des Kerns wurde auf etwa 10-15 m oder 100.000 mal kleiner als das Atom bestimmt. Dies impliziert eine enorme Dichte in der Größenordnung von 1015 g/cm3, die jeder makroskopischen Materie sehr ähnlich ist. Ebenfalls impliziert ist die Existenz bisher unbekannter Kernkräfte, um den enormen abstoßenden Coulomb-Kräften unter den positiven Ladungen im Kern entgegenzuwirken., Riesige Kräfte würden auch mit den großen Energien übereinstimmen, die in der Kernstrahlung emittiert werden.

Abbildung 8. Eine erweiterte Ansicht der Atome in der Goldfolie in Rutherfords Experiment. Kreise stellen die Atome dar (etwa 10-10 m Durchmesser), während die Punkte die Kerne darstellen (etwa 10-15 m Durchmesser). Um sichtbar zu sein, sind die Punkte viel größer als der Maßstab. Die meisten Alphateilchen stürzen durch, sind aber aufgrund ihrer hohen Energie und der geringen Masse des Elektrons relativ unbeeinflusst., Einige gehen jedoch geradeaus in Richtung eines Kerns und sind gerade nach hinten verstreut. Eine detaillierte Analyse gibt die Größe und Masse des Kerns an.
Die geringe Größe des Kerns impliziert auch, dass das Atom im Inneren größtenteils leer ist. Tatsächlich gingen in Rutherfords Experiment die meisten Alphas mit sehr geringer Streuung direkt durch die Goldfolie, da Elektronen so kleine Massen haben und da das Atom größtenteils leer war und das Alpha nichts traf., Zu der Zeit, als Rutherford seine Experimente durchführte, gab es bereits Hinweise darauf, da energetische Elektronen leichter als erwartet in dünne Folien eingedrungen waren. Abbildung 8 zeigt ein Schema der Atome in einer dünnen Folie mit Kreisen, die die Größe der Atome (etwa 10-10 m) und Punkte darstellen, die die Kerne darstellen. (Die Punkte sind nicht zu skalieren-wenn sie wären, würden Sie ein Mikroskop benötigen, um sie zu sehen.) Die meisten Alphateilchen verfehlen die kleinen Kerne und werden nur geringfügig von Elektronen gestreut., Gelegentlich (etwa einmal in 8000-Zeiten in Rutherfords Experiment) trifft ein Alpha frontal auf einen Kern und ist direkt nach hinten verstreut.

Abbildung 9. Rutherfords Planetenmodell des Atoms enthält die Eigenschaften des Kerns, der Elektronen und die Größe des Atoms. Dieses Modell war das erste, das die Struktur von Atomen erkannte, in denen Elektronen mit geringer Masse einen sehr kleinen, massiven Kern in Bahnen umkreisen, die viel größer sind als der Kern. Das Atom ist größtenteils leer und analog zu unserem Planetensystem.,
Basierend auf der Größe und Masse des durch sein Experiment aufgedeckten Kerns sowie der Masse der Elektronen schlug Rutherford das Planetenmodell des Atoms vor. Das Planetenmodell des Atoms zeigt Elektronen mit geringer Masse, die einen Kern mit großer Masse umkreisen. Die Größen der Elektronenbahnen sind im Vergleich zur Größe des Kerns groß, mit größtenteils Vakuum im Atom. Dieses Bild ist analog dazu, wie Planeten mit geringer Masse in unserem Sonnensystem die Sonne mit großer Masse in großen Entfernungen im Vergleich zur Größe der Sonne umkreisen., Im Atom ist die attraktive Coulomb-Kraft analog zur Gravitation im Planetensystem. (Siehe Abbildung 9).) Beachten Sie, dass ein Modell oder ein mentales Bild benötigt wird, um experimentelle Ergebnisse zu erklären, da das Atom zu klein ist, um direkt mit sichtbarem Licht beobachtet zu werden.
Rutherford das planetarische Modell des atoms war entscheidend für das Verständnis der Eigenschaften von Atomen und deren Wechselwirkungen und Energien, wie wir sehen werden in den nächsten Abschnitten. Es war auch ein Hinweis darauf, wie unterschiedlich die Natur von der bekannten klassischen Welt auf der kleinen, quantenmechanischen Skala ist., Die Entdeckung einer Unterstruktur für alle Materie in Form von Atomen und Molekülen wurde nun einen Schritt weiter vorangetrieben, um eine Unterstruktur von Atomen aufzudecken, die einfacher war als die damals bekannten 92 Elemente. Wir haben weiterhin nach tieferen Unterstrukturen gesucht, wie sie sich im Kern befinden, mit etwas Erfolg. In späteren Kapiteln werden wir dieser Suche in der Diskussion über Quarks und andere Elementarteilchen folgen und uns die Richtung ansehen, in die die Suche jetzt zu gehen scheint.,
PhET Erkundungen: Rutherford-Streuung
Wie hat Rutherford herauszufinden, die Struktur des atoms, ohne in der Lage, es zu sehen? Simulieren Sie das berühmte Experiment, in dem er das Plum Pudding-Modell des Atoms widerlegte, indem Sie Alphateilchen beobachten, die von Atomen abprallen, und feststellen, dass sie einen kleinen Kern haben müssen.
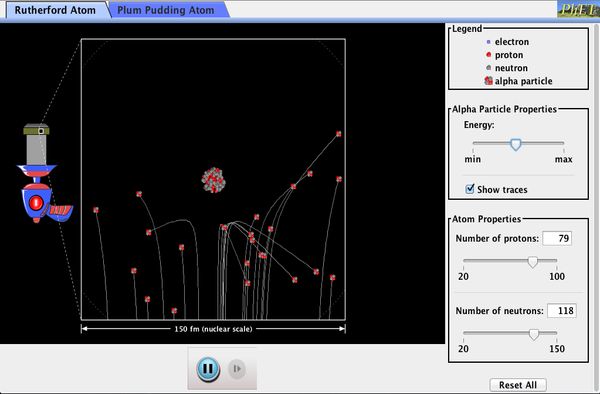
Klicken Sie auf herunterladen, um die simulation. Laufen mit Java.,