us Pharm. 2020;45(9):27-29.
ABSTRACT: sinds synthetische hormonen voor het eerst werden gecombineerd in de jaren 1940, is hormoonsubstitutietherapie op grote schaal gebruikt door vrouwen die ongewenste menopauzale symptomen ondervonden. Het daaropvolgende onderzoek leidde tot ontdekkingen van verscheidene negatieve gevolgen verbonden aan het gebruik van hormoontherapie, die discussies over de risico ‘ s versus de voordelen van hormonale behandeling aanwakkeren., Vanwege de risico ‘ s verbonden aan commerciële preparaten, samengestelde hormoontherapie (CHT) is prominenter geworden, omdat het is aangeprezen als een biologisch gelijkwaardig alternatief voor synthetische hormonen. Echter, vanwege minimale tot geen FDA toezicht in het samengestelde rijk in het algemeen, CHT kan niet zo veilig als is geadverteerd. In 2018, gebaseerd op gunstige testresultaten, werd Bijuva de eerste FDA-goedgekeurde bioidentical combinatie 17-bèta estradiol-progesteron formulering.,
al decennia lang gebruiken vrouwen hormoonsubstitutietherapie voor de behandeling van ongunstige vasomotorische symptomen geassocieerd met de menopauze, zoals opvliegers en nachtelijk zweten. Vrouwen kunnen tot een derde van hun leven doorbrengen in een hormoondeficiënte toestand, die verder bijdraagt aan dergelijke ongewenste effecten zoals stemmingswisselingen, verhoogd risico op osteoporose en verminderd libido. Systemisch oestrogeen is de meest effectieve behandeling voor vasomotorische symptomen, terwijl urogenitale symptomen geassocieerd met de menopauze moeten worden behandeld met een lage dosis actueel oestrogeen.,1 de observationele studie van de gezondheid van vrouwen in het hele land gevonden dat vrouwen vasomotorische symptomen ervaren voor een gemiddelde van 7,4 jaar na de menopauze.2 echter, de meeste artsen adviseren dat de behandeling duurt niet langer dan 5 jaar na de menopauze en sterk raden het vermijden van hormoontherapie helemaal bij vrouwen ouder dan 60 jaar.1 de arts dient de risico ‘ s en voordelen van synthetische en samengestelde hormonen zorgvuldig af te wegen en daarbij rekening te houden met het primaire doel om de kwaliteit van leven van de patiënt te verbeteren.,
bio-identieke hormonen
bio-identieke hormonen, zoals oestrogenen, progestinen en androgenen, zijn verbindingen die worden bereid volgens USP-hoofdstuk <795> niet-steriel samenstellende standaarden. Deze hormonen kunnen worden samengesteld in een verscheidenheid van doseringen en doseringsvormen, waardoor vele opties voor vrouwen die geïnteresseerd zijn in samengestelde hormoontherapie (CHT)., Samengestelde formuleringen ondergaan niet de strenge productie-en zuiverheidsnormen testen dat hun FDA-goedgekeurde tegenhangers doen; echter, ondanks deze ongereguleerde omgeving, CHT is zeer populair bij patiënten op zoek naar meer “gepersonaliseerde” geneeskunde.
de endocriene samenleving heeft samengestelde bio-identieke hormonen gedefinieerd als ” verbindingen die exact dezelfde chemische en moleculaire structuur hebben als hormonen die in het menselijk lichaam worden geproduceerd.,”3 de FDA stelt dat de term bio-identieke hormoon is puur een marketing strategie, omdat er geen wetenschappelijke basis voor een impliciete voordeel of risico vermindering voor CHT ten opzichte van FDA-goedgekeurde synthetische hormoontherapie.3
Synthetische hormoontherapie
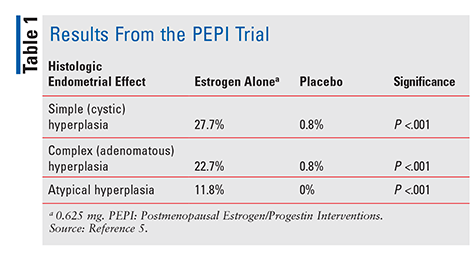
de FDA keurde diethylstilbestrol in 1941 en conjugated equine oestrogenen (CEE) in 1942 goed voor de behandeling van menopauzale symptomen.4 beginnend in de jaren 1960, oestrogeenverkoop omhooggeschoten tot 1975, toen de rapporten opgedoken dat het oestrogeengebruik met een verhoogd risico van endometriumkanker zou kunnen worden geassocieerd.,4 nochtans, werden deze rapporten grotendeels genegeerd, en ging het oestrogeengebruik door. Niet tot 1996, toen de postmenopausal oestrogeen / Progestin interventies (PEPI) proef werd gepubliceerd, begonnen de zorgverleners echt de potentiële negatieve gevolgen verbonden aan oestrogeentherapie te begrijpen. PEPI was een 3 jaar durende gerandomiseerde, placebo-gecontroleerde, dubbelblinde, multicenter studie die de histologische endometrium effecten van therapie met synthetisch niet-tegengesteld oestrogeen versus drie verschillende regimes van synthetisch oestrogeen plus progestine onderzocht.,5
in het PEPI-onderzoek ontwikkelden significant meer patiënten die alleen oestrogeen kregen eenvoudige, complexe of atypische endometriumhyperplasie versus patiënten die placebo kregen (tabel 1). Bovendien waren, hoewel de exacte percentages niet werden gespecificeerd, de percentages hyperplasie bij patiënten die een van de drie oestrogeen-plus-progestine regimes kregen, vergelijkbaar met die bij patiënten die placebo kregen.5 samengevat, toediening van alleen oestrogeen in een dosering van 0.,625 mg per dag leidde tot een beduidend verhoogde weerslag van endometriumhyperplasia, terwijl het combineren van CEE met progestin het endometrium van overgroei in aanzienlijke mate beschermde.Vanwege dit bewezen risico op endometriumkanker, wordt progestine altijd gegeven in combinatie met oestrogeen bij vrouwen met een intacte baarmoeder. Verder bevestigend dit risico, beschreef een 2007 gevalsreeks drie vrouwen die CHT gebruikten die subtherapeutische doses van progestine bevatten en later endometriumkanker ontwikkelden.,6
De PEPI proef, samen met de resultaten op 16,068 postmenopauzale vrouwen uit de Women ‘ s Health Initiative (WHI), gepubliceerd in 2002, licht werpen op de ernstige bezwaren in de jaren 1970.7 Hoewel het PEPI studie toonden geen verhoogd risico van hyperplasie met de combinatie van het product, de WHI gevonden significant verhoogde risico ‘ s van synthetische hormonen gebruiken, zoals hart-en vaatziekten, beroerte, trombo-embolische voorvallen, en borstkanker.,1 jaar na stopzetting van de combinatie Cee/medroxyprogesteronacetaattherapie was er een 80% verhoogd risico op cardiovasculaire aandoeningen en een 37% verhoogd risico op ischemische beroerte tijdens de interventiefase met combinatietherapie. Ook was het risico op borstkanker significant verhoogd (24%) tijdens de interventie. Het gebruik van oestrogeen-plus-progestin verstrekte sommige voordelen, met patiënten die een verminderde weerslag van vaginale atrofie opmerken, verminderde vasomotorische symptomen zoals opvliegers en nachtelijk zweten, en een 38% verminderd risico van colorectal kanker tijdens behandeling met combinatietherapie.,Vanwege het belang van het verhoogde risico op borstkanker en trombo-embolische voorvallen werd de studie niettemin vroegtijdig stopgezet.
samengestelde hormoontherapie
de hierboven besproken risico ‘ s maakten de weg vrij voor CHT advocacy omdat men dacht dat het aanpassen of personaliseren van CHT aan de individuele patiënt het voordeel zou maximaliseren en het risico zou minimaliseren. Beweringen dat CHT veiliger en biologisch vriendelijker was, werden prominenter en het gebruik ervan nam toe., Pinkerton en Santoro gebruikten twee verschillende onderzoeken-Harris en Rose – om de kennis van patiënten over CHT te beoordelen en het gebruik van CHT versus FDA-goedgekeurde hormoontherapie te kwantificeren, respectievelijk.8 Resultaten van de Harris survey gaven aan dat 86% van de vrouwen in de leeftijd van 40 tot 65 jaar niet op de hoogte waren dat CHT niet was goedgekeurd door de FDA, en geëxtrapoleerde resultaten van de Rose survey suggereerden dat jaarlijks tot 2,5 miljoen vrouwen ouder dan 40 jaar CHT kunnen gebruiken.Uit gegevens van beide onderzoeken bleek dat een arts of apotheker CHT had aanbevolen., Deze resultaten suggereren dat er een mogelijkheid bestaat voor aanbieders om ervoor te zorgen dat patiënten worden geïnformeerd over het product dat ze ontvangen, met inbegrip van alle mogelijke risico ‘ s in verband met hormoontherapie, en voor het samenstellen van apothekers om ervoor te zorgen dat ze leveren een therapeutisch zuiver product dat patiënten kunnen vertrouwen.
omdat de FDA niet verantwoordelijk is voor de standaardisatie van samengestelde producten, valt de regelgeving vaak onder de staatsraden voor farmacie., Deze besturen hebben meestal niet de middelen om regelmatige inspecties van samengestelde apotheken uit te voeren, en de FDA grijpt alleen in wanneer een klacht wordt ingediend.9 hoewel samengestelde formuleringen wettelijk niet verplicht zijn risicowaarschuwingen te dragen, kunnen deze producten in theorie dezelfde risico ‘ s opleveren als die welke hierboven voor synthetische hormoontherapie zijn vermeld. Tot op heden zijn er echter geen head-to-head Veiligheidsstudies van CHT versus synthetische hormonen geweest.,10
Er zijn drie soorten oestrogenen die een vrouw kan krijgen als onderdeel van een samengesteld hormoonvervangingsregime: estrone (E1), estradiol (E2) en oestriol (E3), elk met een variërende mate van potentie (E2 > E1 > E3).9 omdat zij voor dezelfde receptor strijden, werken deze oestrogenen als concurrerende inhibitors, resulterend in verminderde doeltreffendheid indien niet correct gebalanceerd.,Daarom ontwikkelden voorstanders van CHT Biest (E2 + E3 in een 20/80 formulering) en Triest (E1 + E2 + E3 in een 10/10/80 formulering) om de fysiologische potentie te maximaliseren, maar er is momenteel geen bewijs om de bewering te ondersteunen dat deze formuleringen in deze verhoudingen enig veiligheidsvoordeel bieden in vergelijking met synthetische hormoontherapie.11
hoewel CHT over het algemeen onvoldoende is onderzocht en niet gereguleerd, werd BIJUVA in oktober 2018, op basis van bevindingen uit de REPLENISH-studie, de eerste door de FDA goedgekeurde bioidentische combinatie 17-bèta-estradiol-progesteronformulering., REPLENISH, een fase III, gerandomiseerd, dubbelblind, placebogecontroleerd, multicenter onderzoek, onderzocht de werkzaamheid, veiligheid van het endometrium en algehele veiligheid van vier verschillende doseringen van een enkele 17-beta estradiol-progesteron capsule voor matige tot ernstige vasomotorische symptomen bij postmenopauzale vrouwen.Het primaire veiligheidseindpunt was de incidentie van endometriumhyperplasie na 12 maanden. Na 12 maanden werden geen gevallen van endometriumhyperplasie waargenomen voor een van de doseringsformuleringen van estradiol-progesteron.,Na 12 weken vertoonde de formulering van 1 mg estradiol-progesteron 100 mg de grootste statistisch significante vermindering in vasomotorische symptoomfrequentie en-ernst vergeleken met placebo, terwijl de primaire standaarden voor veiligheidseindpunten gehandhaafd bleven.12 echter, zoals eerder vermeld, zijn er geen proeven geweest die de veiligheid van synthetische hormonen vergeleken met bio-identieke hormoonformuleringen, zodat theoretisch de risico ‘ s blijven.,
conclusie
Op basis van de REPLENISH-studie hebben pre -, peri-en postmenopauzale vrouwen nu een gestandaardiseerde, gereguleerde, bio-identieke, door de FDA goedgekeurde behandeling voor vasomotorische symptomen. Toekomstige onderzoeken zijn nodig om het veiligheidsprofiel van 17-bèta-estradiol en CHT volledig af te bakenen. Apothekers moeten elke orale hormoonformulering voor de kortst mogelijke duur aanbevelen., Bovendien, als CHT wordt gekozen, apothekers moeten ervoor zorgen dat hun patiënten weten wat CHT is en hoe het verschilt van synthetische hormonen, terwijl ook het hebben van een openhartig gesprek over de voordelen en risico ‘ s van hormoonvervangingstherapie.
1. Martin KA, Manson JE. Benader de patiënt met menopauzale symptomen. J Clin Endocrinol Metab. 2008;93(12):4567-4575.
2. Avis NE, Crawford SL, Greendale G, et al. Duur van de menopauzale vasomotorische symptomen tijdens de overgang van de menopauze. Jama Intern Med. 2015;175(4):531-539.
3. Santoro N, Braunstein GD, Butts CL, et al., Compounded bioidentical hormones in endocrinology practice: an Endocrine Society scientific statement. J Clin Endocrinol Metab. 2016;101(4):1318-1343.
4. Stefanick ML. Oestrogenen en progestins: achtergrond en geschiedenis, trends in gebruik, en richtlijnen en regimes goedgekeurd door de Amerikaanse Food and Drug Administration. Am J Med. 2005; 118 (suppl 12B): 64-73.
5. Schrijfgroep voor het PEPI proces. Effecten van hormoonsubstitutietherapie op endometriumhistologie bij postmenopauzale vrouwen. De postmenopausal oestrogeen / Progestin interventies (PEPI) proef. JAMA. 1996;275(5):370-375.
6., Eden JA, Hacker NF, Fortune M. drie gevallen van endometriumkanker geassocieerd met “bio-identieke” hormoonvervangingstherapie. Med J Aust. 2007;187(4):244-245.
7. Rossouw JE, Anderson GL, Prentice RL, et al. Risico ‘ s en voordelen van oestrogeen plus progestin in gezonde postmenopausal vrouwen: belangrijkste resultaten van het gezondheidsinitiatief van vrouwen gerandomiseerde gecontroleerde proef. JAMA. 2002;288(3):321-333.
8. Pinkerton JV, Santoro N. Compounded bioidentical hormone therapy: het identificeren van gebruik trends en kennis hiaten onder ons vrouwen. Menopauze. 2015;22(9):926-936.
9. Bhavnani BR, Stanczyk FZ., Misvatting en zorgen over bio-identieke hormonen gebruikt voor aangepaste samengestelde hormoontherapie. J Clin Endocrinol Metab. 2012;97(3):756-759.
10. Bijuva (estradiol en progesteron) bijsluiter. Boca Raton, FL: TherapeuticsMD, Inc; November 2019.
11. Kuhl H. farmacologie van oestrogenen en progestogenen: invloed van verschillende toedieningswegen. Climacterisch. 2005; 8 (suppl 1): 3-63.
12. Lobo RA, Archer DF, Kagan R, et al. Een mondelinge capsule 17beta-estradiol-progesterone voor vasomotorische symptomen in postmenopausal vrouwen: een gerandomiseerde gecontroleerde proef. Verloskundige Gynaecol., 2018;132(1):161-170.
de inhoud in dit artikel dient uitsluitend ter informatie. De inhoud is niet bedoeld als vervanging voor professioneel advies. Het vertrouwen op de informatie in dit artikel is uitsluitend op eigen risico.