lang antwoord. Ten eerste moet een onderscheid worden gemaakt tussen de polariteit van een binding en de polariteit van een molecuul (of verbinding).
Bondpolariteit verwijst naar een scheiding van elektrische lading die het resultaat is van een verschil in elektronegativiteit tussen de twee atomen of groepen die samenbinden.,
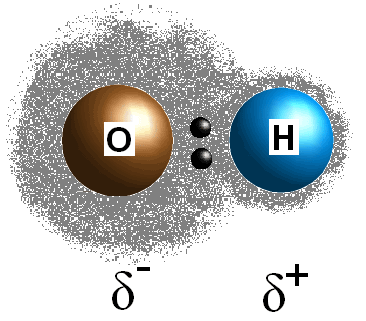
Dit verschil in elektronegativiteitswaarden tussen de twee atomen zorgt ervoor dat de elektronen van de binding ongelijk gedeeld worden, waardoor een postieve lading (#delta^+#) op het minder elektronegatieve atoom ontstaat en een gedeeltelijke negatieve lading (#delta^(-)#) op het meer elektronegatieve atoom. De polariteit van een binding kan worden bepaald met uitsluitend de elektronegativiteits waarden van de twee samenstellende atomen.
indien de binding tussen de twee atomen niet polair is, is het verschil in elektronegativiteit tussen de twee atomen kleiner dan 0.,5, dan zal uw molecuul apolair zijn. Als de binding inderdaad polair is, kun je proberen de polariteit van het molecuul te bepalen.
de geometrie van een molecuul is een belangrijke factor bij het bepalen van de polariteit van een molecuul. Deze eerder genoemde gedeeltelijke ladingen geven aanleiding tot een bond dipoolmoment, # mu#.
als de oriëntaties van deze bindingsdipoolmomenten elkaar opheffen, dan zou het molecuul apolair zijn. Als ze dat echter niet doen, heb je te maken met een polair molecuul.,
enkele voorbeelden waarbij bindingsdipoolmomenten elkaar opheffen, wat resulteert in een apolair molecuul:
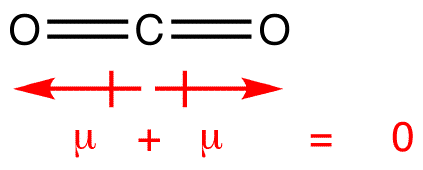
Dipoolmomenten worden getekend met de pijl die wijst naar het meer elektronegatieve atoom en de positieve kant op het minder elektronegatieve atoom. Merk op dat Voor #CO_2#, die twee polaire bindingen heeft, het totale dipoolmoment nul is, omdat deze twee pijlen elkaar opheffen. Dit resulteert in een apolair molecuul., Hetzelfde kan gezegd worden voor #BF_3#:
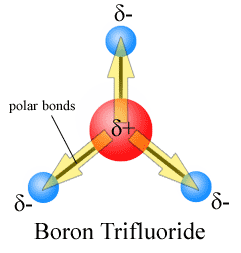
De drie dipoolmomenten heffen elkaar op als gevolg van de symmetrische rangschikking van de bindingen (zie meer over Vector optellen).
een assymetrische opstelling van de partiële ladingen resulteert in een polair molecuul, zoals je kunt zien voor water:
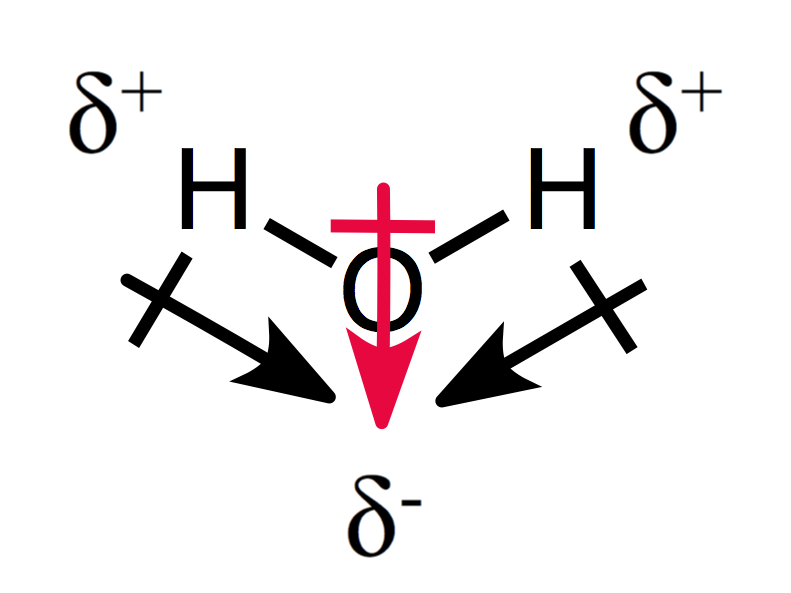
De twee dipoolmomenten voegen aan elkaar toe en creëren een totaal dipoolmoment, en dus een polair molecuul.,
om de polariteit van een molecuul te kunnen voorspellen, moet u bekend zijn met Lewis-structuren, elektronegativiteit, VSEPR-theorie en bond-polariteit.