leerdoelen
aan het einde van deze sectie kunt u:
- beschrijven hoe elektronen werden ontdekt.
- verklaar het Millikan oil drop experiment.
- Beschrijf Rutherford ‘ s gold foil experiment.
- Beschrijf Rutherford ‘ s planetaire model van het atoom.
net zoals atomen een substructuur van materie zijn, zijn elektronen en kernen substructuren van het atoom., De experimenten die werden gebruikt om elektronen en kernen te ontdekken onthullen enkele van de basiseigenschappen van atomen en kunnen gemakkelijk worden begrepen met behulp van ideeën zoals elektrostatische en magnetische kracht, al behandeld in vorige hoofdstukken.
ladingen en elektromagnetische krachten
in eerdere discussies hebben we opgemerkt dat positieve lading geassocieerd is met kernen en negatieve lading met elektronen. We hebben ook veel aspecten behandeld van de elektrische en magnetische krachten die ladingen beïnvloeden., We zullen nu de ontdekking van het elektron en de kern als substructuren van het atoom onderzoeken en hun bijdragen aan de eigenschappen van atomen onderzoeken.
het elektron

figuur 1. Een gasontladingslang gloeit wanneer er een hoge spanning op wordt aangebracht. Elektronen die van de kathode worden uitgezonden, worden versneld naar de anode; ze wekken atomen en moleculen op in het gas, die als reactie oplichten., Ooit genoemd Geissler buizen en later Crookes buizen, ze zijn nu bekend als kathode-ray buizen (CRT ‘s) en worden gevonden in oudere tv’ s, computerschermen, en x-ray machines. Wanneer een magnetisch veld wordt toegepast, buigt de bundel in de richting die wordt verwacht voor negatieve lading. (credit: Paul Downey, Flickr)
gasontladingslangen, zoals weergegeven in Figuur 1, bestaan uit een geëvacueerde glazen buis met twee metalen elektroden en een ijl gas. Wanneer een hoge spanning wordt toegepast op de elektroden, gloeit het gas. Deze buizen waren de voorlopers van de huidige neonlampen., Ze werden voor het eerst serieus bestudeerd door Heinrich Geissler, een Duitse uitvinder en glasblazer, beginnend in de jaren 1860. de Engelse wetenschapper William Crookes, onder anderen, ging verder met het bestuderen van wat enige tijd Crookes buizen werden genoemd, waarin elektronen worden bevrijd van atomen en moleculen in het verheven gas in de buis en worden versneld van de kathode (negatief) naar de anode (positief) door het hoge potentieel., Deze “kathodestralen” botsen met de gasatomen en moleculen en wekken ze op, wat resulteert in de emissie van elektromagnetische (EM) straling die het pad van de elektronen zichtbaar maakt als een straal die zich verspreidt en vervaagt als het zich van de kathode verwijdert.
gasontladingsbuizen worden tegenwoordig meestal kathodestraalbuizen genoemd, omdat de stralen afkomstig zijn van de kathode. Crookes toonde aan dat de elektronen momentum dragen (ze kunnen een klein peddelwiel laten draaien)., Hij vond ook dat hun normaal rechte pad wordt gebogen door een magneet in de richting verwacht voor een negatieve lading bewegen van de kathode. Dit waren de eerste directe indicaties van elektronen en hun lading.

Figuur 2. J. J. Thomson (credit: www.firstworldwar.com, via Wikimedia Commons)
de Engelse natuurkundige J. J. Thomson (1856-1940) verbeterde en breidde de scope van experimenten met gasontladingbuizen uit. (Zie Figuur 2 en Figuur 3., Hij verifieerde de negatieve lading van de kathodestralen met zowel magnetische als elektrische velden. Daarnaast verzamelde hij de stralen in een metalen beker en vond een overmaat van negatieve lading. Thomson was ook in staat om de verhouding van de lading van het elektron tot zijn massa te meten, \frac{q_e}{m_e}\\—een belangrijke stap om de werkelijke waarden van zowel qe als me te vinden. Figuur 4 toont een kathodestraalbuis, die een smalle bundel elektronen produceert die door oplaadplaten gaat die zijn aangesloten op een hoogspanningsvoeding., Tussen de laadplaten wordt een elektrisch veld E geproduceerd en de kathodestraalbuis wordt tussen de polen van een magneet geplaatst, zodat het elektrische veld E loodrecht staat op het magnetische veld B van de magneet. Deze velden, die loodrecht op elkaar staan, produceren tegengestelde krachten op de elektronen. Zoals besproken voor massaspectrometers in Meer Toepassingen van magnetisme, als de netto kracht als gevolg van de velden verdwijnt, dan is de snelheid van het geladen deeltje v=\frac{E}{B}\\., Op deze manier bepaalde Thomson de snelheid van de elektronen en verplaatste vervolgens de bundel op en neer door het elektrische veld aan te passen.

Figuur 3. Diagram van Thomson ‘ s CRT. (credit: Kurzon, Wikimedia Commons)

Figuur 4. Dit schema toont de elektronenbundel in een CRT die door gekruiste elektrische en magnetische velden gaat en fosfor veroorzaakt om te gloeien bij het raken van het uiteinde van de buis.
Verzameltermen, we hebben \frac{q_e}{m_e}=\frac{a}{E}\\.,
Wat is er zo belangrijk aan \frac{q_e}{m_e}\\, de verhouding van de lading van het elektron tot zijn massa? De verkregen waarde is
\displaystyle\frac{q_e}{m_e}=-1.76\times10^{11}\text{ C/kg (elektron)}\\
Dit is een enorm getal, zoals Thomson besefte, en het impliceert dat het elektron een zeer kleine massa heeft. Het was bekend van galvaniseren dat ongeveer 108 C / kg nodig is om een materiaal te plaatsten, een factor van ongeveer 1000 minder dan de lading per kilogram elektronen., Thomson ging verder met hetzelfde experiment voor positief geladen waterstofionen (nu bekend als kale protonen) en vond een lading per kilogram ongeveer 1000 keer kleiner dan die voor het elektron, wat impliceert dat het proton ongeveer 1000 keer zwaarder is dan het elektron. Vandaag weten we meer precies dat
\displaystyle\frac{q_p}{m_p}=9.58\times10^{7}\text{ C/kg (proton)}\\,
waar qp de lading van het proton is en mp de massa is. Deze verhouding (tot vier significante cijfers) is 1836 keer minder lading per kilogram dan voor het elektron., Aangezien de ladingen van elektronen en protonen gelijk zijn in grootte, impliceert dit MP = 1836me.
Thomson voerde verschillende experimenten uit met verschillende gassen in ontladingsbuizen en met behulp van andere methoden, zoals het foto-elektrisch effect, voor het vrijmaken van elektronen uit atomen. Hij vond altijd dezelfde eigenschappen voor het elektron, waaruit bleek dat het een onafhankelijk deeltje was. Voor zijn werk, waarvan hij in 1897 de belangrijkste stukken begon te publiceren, kreeg Thomson in 1906 de Nobelprijs voor de natuurkunde., Achteraf gezien is het moeilijk te begrijpen hoe verbazingwekkend het was om te ontdekken dat het atoom een onderstructuur heeft. Thomson zelf zei: “pas toen ik ervan overtuigd was dat het experiment er geen ontsnapping aan achterliet, publiceerde ik mijn geloof in het bestaan van lichamen die kleiner zijn dan atomen.”
Thomson probeerde de lading van individuele elektronen te meten, maar zijn methode kon de lading slechts in de verwachte orde van grootte bepalen.sinds Faraday ‘ s experimenten met galvaniseren in de jaren 1830 was bekend dat ongeveer 100.000 C per mol nodig was om enkel geïoniseerde ionen te plaatsten., Gedeeld door het aantal ionen per mol (dat wil zeggen door het getal van Avogadro), dat ongeveer bekend was, werd de lading per ion berekend op ongeveer 1,6 × 10-19 C, dicht bij de werkelijke waarde.

Figuur 5. Robert Millikan (credit: Unknown Author, via Wikimedia Commons)
Een Amerikaanse natuurkundige, Robert Millikan (1868-1953) (zie Figuur 5), besloot om Thomson ‘ s experiment voor het meten van qe te verbeteren en werd uiteindelijk gedwongen om een andere aanpak te proberen, die nu een klassiek experiment is uitgevoerd door studenten., Het Millikan-oliedruppelexperiment is weergegeven in Figuur 6.
in het Millikan oil drop experiment worden fijne druppels olie uit een verstuiver gespoten. Sommige van deze worden opgeladen door het proces en kunnen dan worden opgehangen tussen metalen platen door een spanning tussen de platen. In deze situatie wordt het gewicht van de val gecompenseerd door de elektrische kracht:
m dropg = qe E

Figuur 6., Het Millikan oil drop experiment produceerde de eerste nauwkeurige directe meting van de lading op elektronen, een van de meest fundamentele constanten in de natuur. Fijne druppels olie worden opgeladen wanneer gespoten. Hun beweging wordt waargenomen tussen metalen platen met een potentiaal toegepast om de gravitatiekracht tegen te gaan. De balans van zwaartekracht en elektrische krachten maakt de berekening van de lading op een daling. De lading blijkt te worden gekwantiseerd in eenheden van -1,6 × 10-19 C, waardoor direct de lading van de overtollige en ontbrekende elektronen op de olie druppels.,
het elektrische veld wordt geproduceerd door de toegepaste spanning, dus E= \ frac{V}{d}\\, en V wordt aangepast om het gewicht van de druppel te balanceren. De druppels kunnen worden gezien als punten van gereflecteerd licht met behulp van een microscoop, maar ze zijn te klein om hun grootte en massa direct te meten. De massa van de daling wordt bepaald door te observeren hoe snel deze valt wanneer de spanning wordt uitgeschakeld. Omdat de luchtweerstand erg belangrijk is voor deze submicroscopische druppels, vallen de meer massieve druppels sneller dan de minder massieve, en geavanceerde sedimentatieberekeningen kunnen hun massa onthullen., Olie wordt gebruikt in plaats van water, omdat het niet gemakkelijk verdampt, en dus massa is bijna constant. Zodra de massa van de val bekend is, wordt de lading van het elektron gegeven door de vorige vergelijking te herschikken:
\displaystyle{q}=\frac{m_{\text{drop}}} g} {E}=\frac{m_{\text{drop}} gd} {V}\\,
waarbij d de scheiding van de platen is en V de spanning is die de val bewegingloos houdt. (Dezelfde druppel kan gedurende enkele uren worden waargenomen om te zien dat het echt bewegingloos is., In 1913 had Millikan de lading van het elektron qe gemeten met een nauwkeurigheid van 1%, en hij verbeterde dit binnen een paar jaar met een factor 10 tot een waarde van -1.60 × 10-19 C. Hij merkte ook op dat alle ladingen veelvouden van de basiselektronenlading waren en dat plotselinge veranderingen konden optreden waarbij elektronen werden toegevoegd of verwijderd uit de druppels. Voor deze zeer fundamentele directe meting van qe en voor zijn studies van het foto-elektrisch effect, ontving Millikan in 1923 de Nobelprijs voor de natuurkunde.,
als de lading van het elektron bekend is en de lading-massaverhouding bekend is, kan de massa van het elektron worden berekend. Het is
\displaystyle{m}=\frac{q_e}{\left(\frac{q_e}{m_e}\right)}\\
het Vervangen van bekende waarden oplevert
\displaystyle{m}_e=\frac{-1.60\times10^{-19}\text{ C}}{-1.76\times10^{11}\text{ C/kg}}\\
of me = 9.11 × 10-31 kg (elektron massa), waar de ronde-off fouten zijn gecorrigeerd., De massa van het elektron is geverifieerd in vele latere experimenten en is nu bekend met een nauwkeurigheid van beter dan een deel op een miljoen. Het is een ongelooflijk kleine massa en blijft de kleinste bekende massa van elk deeltje dat massa heeft. (Sommige deeltjes, zoals fotonen, zijn massaloos en kunnen niet tot rust worden gebracht, maar reizen met de snelheid van het licht. Een soortgelijke berekening geeft de massa ‘ s van andere deeltjes, inclusief het proton. Tot drie cijfers is de massa van het proton nu bekend als mp = 1,67 × 10-27 kg (Proton ‘ s massa), die bijna identiek is aan de massa van een waterstofatoom., Wat Thomson en Millikan hadden gedaan was het bestaan van een substructuur van atomen bewijzen, het elektron, en verder aan te tonen dat het slechts een fractie van de massa van een atoom. De kern van een atoom bevat het grootste deel van zijn massa, en de aard van de kern was volledig onverwacht.
een ander belangrijk kenmerk van de kwantummechanica begon ook te verschijnen. Alle elektronen zijn identiek aan elkaar. De lading en massa van elektronen zijn geen gemiddelde waarden, maar unieke waarden die alle elektronen hebben., Dit geldt voor andere fundamentele entiteiten op submicroscopisch niveau. Alle protonen zijn identiek aan elkaar, enzovoort.
de kern
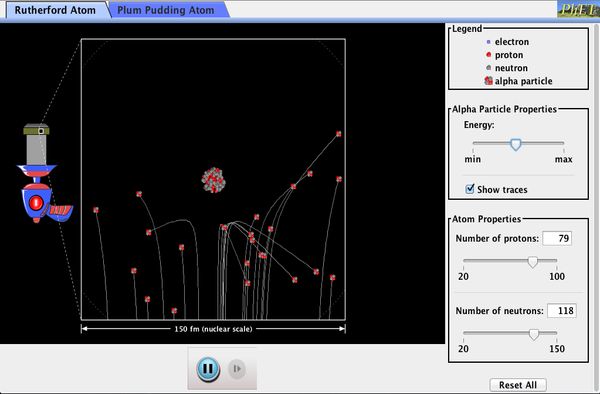
Hier onderzoeken we het eerste directe bewijs van de grootte en massa van de kern. In latere hoofdstukken zullen we veel andere aspecten van de kernfysica onderzoeken, maar de basisinformatie over kerngrootte en-massa is zo belangrijk om het atoom te begrijpen dat we het hier beschouwen.nucleaire radioactiviteit werd ontdekt in 1896 en werd al snel het onderwerp van intensief onderzoek door een aantal van de beste wetenschappers ter wereld., Onder hen was de Nieuw-Zeelander Lord Ernest Rutherford, die talrijke fundamentele ontdekkingen deed en de titel “vader van de kernfysica” verdiende. Rutherford studeerde aan de Cavendish Laboratories in Engeland voordat hij een baan aan de McGill University in Canada kreeg, waar hij in 1908 de Nobelprijs voor de Scheikunde kreeg. Op het gebied van de atomaire en kernfysica is er veel overlap tussen chemie en fysica, waarbij de fysica de fundamentele enabling theories levert., Hij keerde later terug naar Engeland en had zes toekomstige Nobelprijswinnaars als studenten. Rutherford gebruikte nucleaire straling om direct de grootte en massa van de atoomkern te onderzoeken. Het experiment dat hij bedacht is weergegeven in Figuur 7. Een radioactieve bron die alfastraling uitzendt werd geplaatst in een loodcontainer met een gat in één kant om een bundel alfadeeltjes te produceren, die een type ioniserende straling zijn die door de kernen van een radioactieve bron wordt uitgeworpen., Een dunne gouden folie werd in de bundel geplaatst, en de verstrooiing van de alfadeeltjes werd waargenomen door de gloed die ze veroorzaakten toen ze een fosforscherm raakten.

Figuur 5. Rutherford ‘ s experiment gaf direct bewijs voor de grootte en massa van de kern door alfadeeltjes uit een dunne gouden folie te verstrooien. Alfadeeltjes met energieën van ongeveer 5MeV worden uitgestraald uit een radioactieve bron (een kleine metalen container waarin een specifieke hoeveelheid radioactief materiaal is verzegeld), worden gecollimeerd in een bundel en vallen op de folie., Het aantal deeltjes dat de folie binnendringt of naar verschillende hoeken verstrooit, geeft aan dat de goudkernen zeer klein zijn en bijna alle Massa van het goudatoom bevatten. Dit wordt vooral aangegeven door de alfadeeltjes die zich verspreiden naar zeer grote hoeken, net als een voetbal die van het hoofd van een keeper stuitert.,
alfa-deeltjes waren bekend als de dubbel geladen positieve kernen van heliumatomen met kinetische energieën in de Orde van 5 MeV wanneer deze worden uitgezonden in nucleair verval, dat wil zeggen het uiteenvallen van de kern van een onstabiele nuclide door de spontane emissie van geladen deeltjes. Deze deeltjes interageren met materie meestal via de Coulomb kracht, en de manier waarop ze uit kernen verspreiden kan nucleaire grootte en massa onthullen. Dit is analoog aan het observeren hoe een bowlingbal wordt verspreid door een object dat je niet direct kunt zien., Omdat de energie van het Alfa-deeltje zo groot is in vergelijking met de typische energieën geassocieerd met atomen (MeV versus eV), zou je verwachten dat de alfa-deeltjes gewoon door een dunne folie crashen, net zoals een supersonische bowlingbal door een paar dozijn rijen bowlingpinnen zou crashen. Thomson had voor ogen dat het atoom een kleine bol was waarin gelijke hoeveelheden positieve en negatieve lading gelijkmatig verdeeld waren. De enorme alfadeeltjes zouden in zo ‘ n model slechts kleine afbuigingen ondergaan., In plaats daarvan, Rutherford en zijn medewerkers vonden dat alfadeeltjes af en toe werden verspreid naar grote hoeken, sommige zelfs terug in de richting van waaruit ze kwamen! Gedetailleerde analyse met behoud van momentum en energie—in het bijzonder van het kleine aantal dat recht terug kwam—impliceerde dat gouden kernen zijn zeer klein in vergelijking met de grootte van een goudatoom, bevatten bijna alle van de massa van het atoom, en zijn strak gebonden. Omdat de goudkern meerdere malen zwaarder is dan het Alfa-deeltje, zou een frontale botsing het Alfa-deeltje rechtstreeks naar de bron toe verspreiden., Bovendien, hoe kleiner de kern, hoe minder alfadeeltjes die één hoofd zouden raken.hoewel de resultaten van het experiment in 1909 door zijn collega ‘ s werden gepubliceerd, duurde het twee jaar voordat Rutherford zich van hun betekenis kon overtuigen. Net als Thomson voor hem, was Rutherford terughoudend om zulke radicale resultaten te accepteren. De natuur op kleine schaal is zo anders dan onze klassieke wereld dat zelfs degenen die op de voorgrond van de ontdekking zijn soms verrast. Rutherford schreef later: “het was bijna net zo ongelooflijk alsof je een 15-inch omhulsel vuurde op een stuk zijdepapier en het kwam terug en raakte je., Bij nader inzien realiseerde ik me dat dit achterstevoren verstrooide . . . . . . het grootste deel van de massa van het atoom was geconcentreerd in een kleine kern.in 1911 publiceerde Rutherford zijn analyse samen met een voorgesteld model van het atoom. De grootte van de kern werd vastgesteld op ongeveer 10-15 m, of 100.000 keer kleiner dan het atoom. Dit impliceert een enorme dichtheid, in de Orde van 1015 g / cm3, sterk in tegenstelling tot elke macroscopische materie. Ook impliciet is het bestaan van voorheen onbekende nucleaire krachten om de enorme afstotende Coulomb krachten tussen de positieve ladingen in de kern tegen te gaan., Enorme krachten zouden ook consistent zijn met de grote energieën die in nucleaire straling worden uitgestraald.

Figuur 8. Een uitgebreid beeld van de atomen in de goudfolie in Rutherford ‘ s experiment. Cirkels vertegenwoordigen de atomen (ongeveer 10-10 m in diameter), terwijl de stippen de kernen (ongeveer 10-15 m in diameter) vertegenwoordigen. Om zichtbaar te zijn, zijn de stippen veel groter dan schaal. De meeste alfa deeltjes crashen door maar zijn relatief onaangetast vanwege hun hoge energie en de kleine massa van het elektron., Sommige, echter, hoofd recht naar een kern en zijn verspreid recht terug. Een gedetailleerde analyse geeft de grootte en massa van de kern.
de kleine grootte van de kern impliceert ook dat het atoom van binnen grotendeels leeg is. In Rutherford ’s experiment gingen de meeste Alfa’ s rechtstreeks door de goudfolie met zeer weinig verstrooiing, omdat elektronen zulke kleine massa ‘ s hebben en omdat het atoom meestal leeg was met niets voor de Alfa om te raken., Er waren al hints van dit op het moment dat Rutherford zijn experimenten uitgevoerd, omdat energetische elektronen waren waargenomen om dunne folies gemakkelijker dan verwacht binnendringen. Figuur 8 toont een schema van de atomen in een dunne folie met cirkels die de grootte van de atomen (ongeveer 10-10 m) en stippen die de kernen. (De stippen zijn niet op schaal-als ze waren, zou je een microscoop nodig om ze te zien. De meeste alfadeeltjes missen de kleine kernen en zijn slechts lichtjes verstrooid door elektronen., Af en toe, (ongeveer een keer in de 8000 keer in Rutherford ‘ s experiment), raakt een alfa een kern frontaal en wordt recht achteruit verspreid.

figuur 9. Rutherford ‘ s planetaire model van het atoom bevat de kenmerken van de kern, elektronen en de grootte van het atoom. Dit model was de eerste om de structuur van atomen te herkennen, waarin lage-massa elektronen om een zeer kleine, massieve kern draaien in banen die veel groter zijn dan de kern. Het atoom is grotendeels leeg en is analoog aan ons planetenstelsel.,op basis van de grootte en de massa van de kern die door zijn experiment werd onthuld, en de massa van de elektronen, stelde Rutherford het planetaire model van het atoom voor. Het planetaire model van het atoom toont elektronen van lage massa die om een kern van grote massa draaien. De grootte van de elektronen banen zijn groot in vergelijking met de grootte van de kern, met meestal vacuüm in het atoom. Dit beeld is analoog aan hoe lage-massa planeten in ons zonnestelsel rond de grote-massa zon draaien op grote afstanden in vergelijking met de grootte van de zon., In het atoom is de aantrekkelijke Coulomb-kracht analoog aan de zwaartekracht in het planetenstelsel. (Zie Figuur 9.) Merk op dat een model of mentaal beeld nodig is om de experimentele resultaten te verklaren, omdat het atoom te klein is om direct waargenomen te worden met zichtbaar licht.Rutherford ‘ s planetaire model van het atoom was cruciaal voor het begrijpen van de karakteristieken van atomen, en hun interacties en energieën, zoals we in de volgende secties zullen zien. Ook was het een indicatie van hoe verschillend de natuur is van de bekende klassieke wereld op de kleine, kwantummechanische schaal., De ontdekking van een substructuur voor alle materie in de vorm van atomen en moleculen werd nu een stap verder gezet om een substructuur van atomen te onthullen die eenvoudiger was dan de 92 elementen die toen bekend waren. We zijn doorgegaan met het zoeken naar diepere substructuren, zoals die in de kern, met enig succes. In latere hoofdstukken zullen we deze zoektocht volgen in de bespreking van quarks en andere elementaire deeltjes, en we zullen kijken naar de richting die de zoektocht nu lijkt te gaan.,
PhET Explorations: Rutherford Scattering
hoe ontdekte Rutherford de structuur van het atoom zonder het te kunnen zien? Simuleer het beroemde experiment waarin hij het Plum Pudding model van het atoom weerlegde door alfa-deeltjes te observeren die afstuiteren van atomen en te bepalen dat ze een kleine kern moeten hebben.
Klik om de simulatie te downloaden. Uitvoeren met behulp van Java.,
Section Summary
Problems & oefeningen
- Rutherford vond de grootte van de kern ongeveer 10-15 m. Dit betekende een enorme dichtheid. Wat zou deze dichtheid voor goud zijn?in Millikan ‘ s oil-drop experiment kijkt men naar een kleine oliedruppel die onbeweeglijk tussen twee platen wordt gehouden. Neem de spanning tussen de platen tot 2033 V, en de plaat scheiding tot 2,00 cm. De oliedaling (van dichtheid 0,81 g / cm3) heeft een diameter van 4,0 × 10-6 m. Vind de lading op de daling, in termen van elektroneneenheden.,
- (a) een aspirant-natuurkundige wil een schaalmodel van een waterstofatoom bouwen voor haar science fair project. Als het atoom 1,00 m in diameter, hoe groot moet ze proberen om de kern te maken? (b) hoe gemakkelijk zal dit zijn om te doen?