membraaneiwitten
terwijl lipiden de fundamentele structurele elementen van membranen zijn, zijn eiwitten verantwoordelijk voor het uitvoeren van specifieke membraanfuncties. De meeste plasmamembranen bestaan uit ongeveer 50% lipide en 50% eiwit in gewicht, waarbij de koolhydraten van glycolipiden en glycoproteïnen 5 tot 10% van de membraanmassa uitmaken. Omdat eiwitten veel groter zijn dan lipiden, komt dit percentage overeen met ongeveer één eiwitmolecuul per elke 50 tot 100 moleculen lipide., In 1972 stelden Jonathan Singer en Garth Nicolson het fluid mozaïekmodel van membraanstructuur voor, dat nu algemeen wordt aanvaard als het basisparadigma voor de organisatie van alle biologische membranen. In dit model worden membranen gezien als tweedimensionale vloeistoffen waarin eiwitten worden ingebracht in lipide bilagen (figuur 12.3).

figuur 12.3
Fluid mosaic model of the plasma membraan., De integrale membraanproteã nen worden ingevoegd in het lipide bilayer, terwijl de perifere proteã nen aan het membraan indirect door eiwit-eiwitinteractie worden gebonden. De meeste integrale membraanproteã nen zijn transmembraanproteã nen (meer…)
Singer en Nicolson onderscheiden twee klassen van membraangeassocieerde eiwitten, die zij perifere en integrale membraaneiwitten noemden., Perifere membraanproteã nen werden operationeel gedefinieerd als proteã nen die van het membraan scheiden na behandelingen met polaire reagentia, zoals oplossingen met extreme pH of hoge zoutconcentratie, die de fosfolipide bilayer niet verstoren. Zodra losgemaakt van het membraan, zijn de perifere membraanproteã nen oplosbaar in waterige buffers. Deze proteã nen worden niet opgenomen in het hydrophobic binnenland van de lipide bilayer. In plaats daarvan, worden zij indirect geassocieerd met membranen door eiwit-eiwitinteractie., Deze interacties hebben vaak betrekking op ionenbindingen, die worden verstoord door extreme pH of hoog zout.
in tegenstelling tot de perifere membraaneiwitten kunnen integrale membraaneiwitten alleen vrijkomen bij behandelingen die de fosfolipide bilaag verstoren. Delen van deze integrale membraanproteã nen worden ingevoegd in het lipide bilayer, zodat kunnen zij slechts door reagentia worden gescheiden die hydrophobic interactie verstoren., De meest gebruikte reagentia voor solubilisatie van integrale membraanproteã nen zijn detergentia, die kleine amfipathische molecules zijn die zowel hydrofobe als hydrofiele groepen bevatten (figuur 12.4). De hydrophobic gedeelten van detergentia verdringen de membraanlipiden en binden aan de hydrophobic gedeelten van integrale membraanproteã nen. Omdat het andere uiteinde van het reinigingsmiddelmolecuul hydrofiel is, zijn de reinigingsmiddel-eiwitcomplexen oplosbaar in waterige oplossingen.

figuur 12.4
Solubilisatie van geïntegreerde membraaneiwitten door detergentia., Detergenten (bijvoorbeeld octylglucoside) zijn amfipathische moleculen die hydrofiele hoofdgroepen en hydrofobe staarten bevatten. De hydrophobic staarten binden aan de hydrophobic gebieden van integraal membraan (meer…)
veel integrale eiwitten zijn transmembraaneiwitten, die de lipide-bilaag overspannen met delen die aan beide zijden van het membraan worden blootgesteld. Deze eiwitten kunnen worden gevisualiseerd in elektronenmicrografen van plasmamembranen bereid door middel van de freeze-fracture techniek (zie figuur 1.35). In deze specimens, wordt het membraan gespleten en scheidt in zijn twee folders., Transmembraanproteã nen zijn dan duidelijk als deeltjes op de interne gezichten van het membraan (figuur 12.5).

figuur 12.5
Vriesfractuur elektronenmicrografie van humane rode bloedcelmembranen. De deeltjes in het membraan zijn transmembraanproteïnen. (Harold H. Edwards / Visuals Unlimited.,)
De membraanoverspannende delen van transmembraaneiwitten zijn gewoonlijk α-helices van 20 tot 25 hydrofobe aminozuren die tijdens de synthese van de polypeptideketen in het membraan van het endoplasmatisch reticulum worden ingebracht (zie figuren 9.11, 9.12 en 9.13). Deze eiwitten worden vervolgens in membraanblaasjes van het endoplasmatisch reticulum naar het Golgi-apparaat getransporteerd en vandaar naar het plasmamembraan., Koolhydraatgroepen worden toegevoegd aan de polypeptidekettingen in zowel het endoplasmatisch reticulum als het Golgi-apparaat, zodat de meeste transmembraanproteïnen van het plasmamembraan glycoproteïnen zijn met hun oligosacchariden die aan het oppervlak van de cel worden blootgesteld.
Studies met rode bloedcellen hebben goede voorbeelden opgeleverd van zowel perifere als integrale eiwitten geassocieerd met het plasmamembraan. De membranen van menselijke erytrocyten bevatten ongeveer een dozijn belangrijke proteã nen, die oorspronkelijk door gelelektroforese van membraanpreparaten werden geà dentificeerd., De meeste hiervan zijn perifere membraaneiwitten die geïdentificeerd zijn als componenten van het corticale cytoskelet, dat ten grondslag ligt aan het plasmamembraan en de vorm van de cel bepaalt (zie hoofdstuk 11). Bijvoorbeeld, is de overvloedigste perifere membraanproteã ne van rode bloedcellen spectrin, die de belangrijkste cytoskeletal proteã ne van erytrocyten is. Andere perifere membraanproteã nen van rode bloedcellen omvatten actin, ankyrin, en band 4.1., Ankyrine is de belangrijkste schakel tussen het plasmamembraan en het cytoskelet door binding aan zowel spectrin als de geïntegreerde membraaneiwitband 3 (Zie figuur 11.11). Een extra verbinding tussen het membraan en het cytoskeleton wordt verstrekt door band 4.1, die aan de verbindingen van spectrin en actin, evenals aan glycophorin (de andere belangrijke integrale membraanproteã ne van erytrocyten) bindt.
de twee belangrijkste geïntegreerde membraaneiwitten van rode bloedcellen, glycophorine en band 3, geven goed bestudeerde voorbeelden van transmembraaneiwitstructuur (figuur 12.6)., Glycophorine is een kleine glycoproteïne van 131 aminozuren, met een molecuulgewicht van ongeveer 30.000, waarvan de helft eiwit en de helft koolhydraten. Glycophorine passeert het membraan met een enkele membraan-overspannende α-helix van 23 aminozuren, waarbij het geglycosyleerde amino-terminale gedeelte aan het celoppervlak wordt blootgesteld. Hoewel glycophorine één van de eerste transmembrane proteã nen was om te worden gekarakteriseerd, blijft zijn nauwkeurige functie onbekend. In tegenstelling, wordt de functie van de andere belangrijke transmembrane proteã ne van rode bloedcellen goed begrepen., Dit eiwit, oorspronkelijk bekend als band 3, is het aniontransporteur verantwoordelijk voor de passage van bicarbonaat (HCO3-) en chloride (Cl-) ionen door het Rode bloedcelmembraan. De polypeptideketen van band 3 bestaat uit 929 aminozuren en heeft vermoedelijk 14 membraanoverspannende α-spiraalvormige gebieden. Binnen het membraan, vormen dimeren van band 3 bolvormige structuren die interne kanalen bevatten waardoor de ionen over het lipide bilayer kunnen reizen.
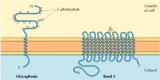
figuur 12.6
geïntegreerde membraaneiwitten van rode bloedcellen., Glycophorine (131 aminozuren) bevat één enkele transmembrane α helix. Het is zwaar glyocosylated, met oligosacchariden in bijlage aan 16 plaatsen op het extracellulaire gedeelte van de polypeptideketen. (meer…)
vanwege hun amfipathische karakter zijn transmembraaneiwitten moeilijk te kristalliseren gebleken, zoals vereist voor driedimensionale structurele analyse door röntgendiffractie., Het eerste transmembraanproteã ne dat door röntgenkristallografie moet worden geanalyseerd was het fotosynthetische reactiecentrum van de bacterie Rhodopseudomonas viridis, waarvan de structuur in 1985 werd gemeld (figuur 12.7). Het reactiecentrum bevat drie transmembraanproteã nen, aangewezen L, M, en H (licht, middel, en zwaar) volgens hun schijnbare grootte die door gelelektroforese wordt vermeld. De subeenheden L en M hebben elk vijf membraanoverspannende α-helices. De subeenheid H heeft slechts één transmembrane α-helix, met het grootste deel van de polypeptideketen aan de cytosolische kant van het membraan., De vierde subeenheid van het reactiecentrum is cytochroom, dat een perifeer membraanproteã ne is die aan het complex door eiwit-eiwitinteractie wordt gebonden.

figuur 12.7
een bacterieel fotosynthetisch reactiecentrum. Het reactiecentrum bestaat uit drie transmembraanproteã nen, aangewezen L (rood), M (geel), en H (groen). De subeenheden L en M hebben elk vijf transmembrane α-helices, terwijl de subeenheid H slechts (meer) heeft…)
hoewel de meeste transmembraaneiwitten het membraan overspannen door α-spiraalvormige gebieden, is dit niet altijd het geval., Een goed gekarakteriseerde uitzondering wordt geboden door de porinen—een klasse van eiwitten die kanalen vormen in de buitenste membranen van sommige bacteriën. Veel bacteriën, waaronder E. coli, hebben een dubbel membraan systeem waarin het plasmamembraan (of binnenmembraan) is omgeven door de celwand en een aparte buitenmembraan (figuur 12.8). In tegenstelling tot het plasmamembraan is het buitenmembraan zeer doorlaatbaar voor ionen en kleine polaire moleculen (in het geval van E. coli, met molecuulgewichten tot 600). Deze permeabiliteit is het gevolg van de porinen, die open waterkanalen vormen door de lipide bilayer., Zoals besproken in hoofdstuk 10, eiwitten met betrekking tot de bacteriële porinen worden ook gevonden in de buitenste membranen van mitochondriën en chloroplasten.
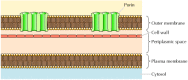
figuur 12.8
bacteriële buitenmembranen. Het plasmamembraan van sommige bacteriën wordt omringd door een celwand en een duidelijk buitenmembraan. Het buitenmembraan bevat porinen, die Open waterige kanalen vormen die de vrije doorgang van ionen en kleine molecules toestaan.
structurele analyse heeft uitgewezen dat de porinen geen hydrofobe α-spiraalvormige gebieden bevatten., In plaats daarvan passeren ze het membraan als β-vaten, waarin 16 β-platen zich vouwen tot een vatachtige structuur die een waterige porie omsluit (figuur 12.9). De zijkettingen van polaire aminozuren lijn de porie, terwijl zijkettingen van hydrophobic aminozuren met het binnenland van het membraan in wisselwerking staan. De porin monomeren associëren om stabiele trimers te vormen, elk van die drie open kanalen bevat waardoor de polaire molecules over het membraan kunnen verspreiden.

figuur 12.9
structuur van een porin monomeer., Elk monomeer is een β-vat bestaande uit 16 antiparallel β-strengen (pijlen). Het bovenste uiteinde van het molecuul is gericht op het externe medium. (Uit H. Nikaido, 1994. J. Biol. Scheikunde. 269: 3905.)
in tegenstelling tot transmembraaneiwitten worden verschillende eiwitten (waarvan vele zich gedragen als integrale membraaneiwitten) in het plasmamembraan verankerd door covalent aangehechte lipiden of glycolipiden (figuur 12.10). Leden van één klasse van deze proteã nen worden in de buitenste folder van het plasmamembraan ingevoegd door glycosylphosphatidylinositol (GPI) ankers., GPI-ankers worden toegevoegd aan bepaalde eiwitten die zijn overgebracht naar het endoplasmatisch reticulum en in het membraan zijn verankerd door een C-terminaal transmembraangebied (zie figuur 9.16). Het transmembraangebied wordt gespleten aangezien het GPI-anker wordt toegevoegd, zodat blijven deze proteã nen in bijlage aan het membraan slechts door glycolipid. Aangezien de polypeptidekettingen van GPI-verankerde proteã nen in het endoplasmic reticulum worden overgebracht, zijn zij geglycosyleerd en op de oppervlakte van de cel na vervoer aan het plasmamembraan blootgesteld.
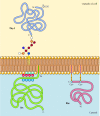
Figuur 12.,10
voorbeelden van eiwitten verankerd in het plasmamembraan door lipiden en glycolipiden. Sommige proteã nen (b.v., de lymfocytenproteã ne Thy-1) worden verankerd in de buitenste folder van het plasmamembraan door GPI ankers toegevoegd aan hun c Eindpunt in het endoplasmic reticulum. (meer…)
andere eiwitten zijn verankerd in de binnenste folder van het plasmamembraan door covalent aangehechte lipiden. Eerder dan wordt verwerkt door de secretory weg, worden deze proteã nen samengesteld op vrije cytosolic ribosomen en dan gewijzigd door de toevoeging van lipiden., Deze modificaties omvatten de toevoeging van myristinezuur (een 14-koolstofvetzuur) aan het amino-eindpunt van de polypeptideketen, de toevoeging van palmitinezuur (16 koolstofatomen) aan de zijketens van cysteïneresiduen en de toevoeging van prenylgroepen (15 of 20 koolstofatomen) aan de zijketens van carboxy-terminale cysteïneresiduen (zie figuren 7.29, 7.30 en 7.31). In sommige gevallen, worden deze proteã nen (waarvan velen zich als perifere membraanproteã nen gedragen) gericht op het plasmamembraan door positief geladen gebieden van de polypeptideketen evenals door de in bijlage opgenomen lipiden., Deze positief geladen eiwitdomeinen kunnen met de negatief geladen hoofdgroepen van phosphatidylserine op het cytosolic gezicht van het plasmamembraan in wisselwerking staan. Het is opmerkelijk dat veel van de proteã nen die in de binnenste folder van het plasmamembraan (met inbegrip van de Proteã nen Src en Ras in Figuur 12.10 worden geà llustreerd) belangrijke rollen in de transmissie van signalen van receptoren van de celoppervlakte aan intracellular doelstellingen spelen, zoals besproken in het volgende hoofdstuk.