een titratie is een volumetrische techniek waarbij een oplossing van één reactant (de titrant) wordt toegevoegd aan een oplossing van een tweede reactant (de “analyt”) totdat het equivalentiepunt is bereikt. Het equivalentiepunt is het punt waarop titrant is toegevoegd in precies de juiste hoeveelheid om stoichiometrisch te reageren met de analyten (wanneer mol van titrant = mol van analyt). Als of titrant of analyte gekleurd is, is het equivalentiepunt duidelijk van de verdwijning van kleur aangezien de reactanten worden verbruikt., Anders kan een indicator worden toegevoegd die een “eindpunt” heeft (van kleur verandert) op het equivalentiepunt, of het equivalentiepunt kan worden bepaald aan de hand van een titratiecurve. De hoeveelheid toegevoegde titrant wordt bepaald aan de hand van de concentratie en het volume:
n (mol) = C (mol/L) * V (L)
en de hoeveelheid titrant kan worden gebruikt in de gebruikelijke stoichiometrische berekening om de hoeveelheid analyt te bepalen.
het titratieproces kan worden waargenomen in de onderstaande video.,
een gemeten volume van de te titreren oplossing, in dit geval kleurloos waterig azijnzuur, CH3COOH(aq), wordt in een bekerglas geplaatst. Het kleurloze natriumhydroxide NaOH (aq), de titrant, wordt zorgvuldig toegevoegd door middel van een buret. Het volume toegevoegde titrant kan dan worden bepaald door het niveau van vloeistof in het buret vóór en na titratie te lezen. Deze meting kan meestal worden geschat op de dichtstbijzijnde honderdste van een milliliter, zodat nauwkeurige toevoegingen van titrant snel kunnen worden gemaakt.,
naarmate de eerste paar milliliter titrant in de erlenmeyer stromen, verandert sommige indicator kort in roze, maar keert snel terug naar kleurloos. Dit komt door een grote overmaat aan azijnzuur. Het beperkende reagens NaOH wordt volledig verbruikt.
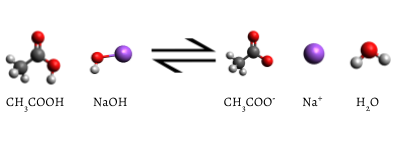
de toegevoegde indicator verandert in roze wanneer de titratie is voltooid, wat aangeeft dat al het waterige azijnzuur is verbruikt door NaOH(aq). De reactie die optreedt is
\
uiteindelijk wordt al het azijnzuur geconsumeerd., Toevoeging van zelfs een fractie van een druppel titrant produceert een blijvende roze kleur als gevolg van niet-gereageerde NaOH in de kolf. De kleurverandering die optreedt op het eindpunt van de indicator geeft aan dat al het azijnzuur is geconsumeerd, dus hebben we het equivalentiepunt van de titratie bereikt. Als er iets meer NaOH-oplossing zou worden toegevoegd, zou er een overmaat zijn en zou de kleur van de oplossing in de kolf veel donkerder worden. Het eindpunt verschijnt plotseling en er moet op worden gelet dat het eindpunt niet wordt overschreden.
nadat de titratie het eindpunt heeft bereikt, wordt een eindvolume uit de buret afgelezen., Aan de hand van de begin-en eindwaarde kan het toegevoegde volume heel precies worden bepaald:
Het doel van een titratie is altijd de hoeveelheid titrant toe te voegen die nodig is om precies de hoeveelheid te consumeren die wordt getitreerd. In de NaOH-CH3COOH reactie Eq. \(\ref{2}\), treedt het equivalentiepunt op wanneer een gelijke Molaire hoeveelheid NaOH is toegevoegd uit de gegradueerde cilinder voor elke mol CH3COOH oorspronkelijk in de titratiekolf., Dat wil zeggen, op het equivalentiepunt moet de verhouding van de hoeveelheid NaOH, toegevoegd aan de hoeveelheid CH3COOH verbruikt gelijk zijn aan de stoichiometrische verhouding
\
titratie wordt vaak gebruikt om de concentratie van een oplossing te bepalen. In veel gevallen is het niet eenvoudig een zuivere stof te verkrijgen, nauwkeurig af te wegen en in een maatkolf op te lossen, zoals in Voorbeeld 1 van Oplossingsconcentraties werd gedaan. NaOH bijvoorbeeld combineert snel met H2O en CO2 uit de lucht, zodat zelfs een vers bereid monster van vaste NaOH niet zuiver is., Het gewicht zou voortdurend veranderen als CO2(g) en H2O (g) werden geabsorbeerd. Waterstofchloride (HCl) is een gas bij gewone temperaturen en drukken, waardoor het zeer moeilijk te hanteren of te wegen. Waterige oplossingen van beide stoffen moeten worden gestandaardiseerd; dat wil zeggen dat hun concentraties moeten worden bepaald door titratie.
verreweg het meest gebruikte gebruik van titraties is bij het bepalen van onbekenden, dat wil zeggen bij het bepalen van de concentratie of hoeveelheid stof in een monster waarvan we aanvankelijk niets wisten. Het volgende voorbeeld gaat over een onbekende die veel mensen tegenkomen elke dag.,
de 308,0 mg die in dit voorbeeld wordt verkregen, komt redelijk overeen met de claim van de fabrikant van 300 mg. De tabletten worden gestempeld door machines, niet afzonderlijk gewogen, en dus enige variatie wordt verwacht.