LANGE SVARET. Først, det må sondres mellom polaritet av en obligasjon og polaritet av et molekyl (eller sammensatte).
Bond polaritet refererer til en separasjon av elektrisk ladning at resultatene fra en forskjell i electronegativity mellom to atomer eller grupper som bånd sammen.,
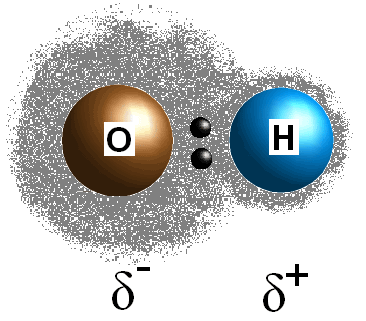
Denne forskjellen i electronegativity verdier mellom to atomer fører til at bond er elektroner til å være felles ulikt, og dermed skape en postive kostnad (#delta^+#) på mindre electronegative atom og en delvis negativ ladning (#delta^(-)#) på mer electronegative atom. Polariteten av en obligasjon kan fastslås ved hjelp av kun electronegativity verdier av de to deltagende atomer.
Hvis bånd mellom de to atomene i ikke polar, jeg.e forskjellen i electronegativity mellom de to atomene er mindre enn 0.,5, så din molekyl vil være non-polar. Hvis bond er faktisk polar, kan du gå videre for å prøve å fastslå polariteten av molekylet.
Et molekyl geometri er en viktig faktor i å bestemme polaritet av et molekyl. Disse nevnte delvis gebyrer gi opphav til en bond dipolmoment, #mu#.
Hvis retningen av disse bond dipol øyeblikk kansellerer hverandre ut, så molekylet sies å være ikke-polare. Men hvis de ikke gjør det, du har å gjøre med en polar-molekylet.,
Noen eksempler der bond dipol øyeblikk kansellerer hverandre ut, noe som resulterer i en ikke-polare molekyler:
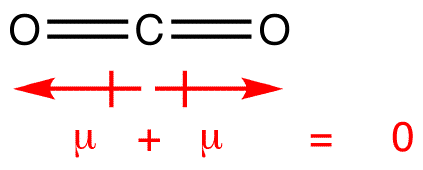
Dipol-øyeblikkene er trukket med pilen peker på flere electronegative atom og pluss-siden på mindre electronegative atom. Legg merke til at for #CO_2#, som har to polare bindinger, den generelle dipolmoment er null, siden disse to piler kansellerer hverandre ut. Dette resulterer i en ikke-polare molekyler., Det samme kan sies for #BF_3#:
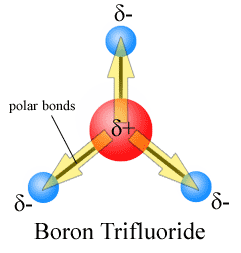
De tre dipol øyeblikk kansellerer hverandre ut som et resultat av den symmetriske plasseringen av obligasjoner (se mer på vektor tillegg).
En assymetrical ordning for delvis avgifter resultater i en polar molekyl, som du kan se for vann:
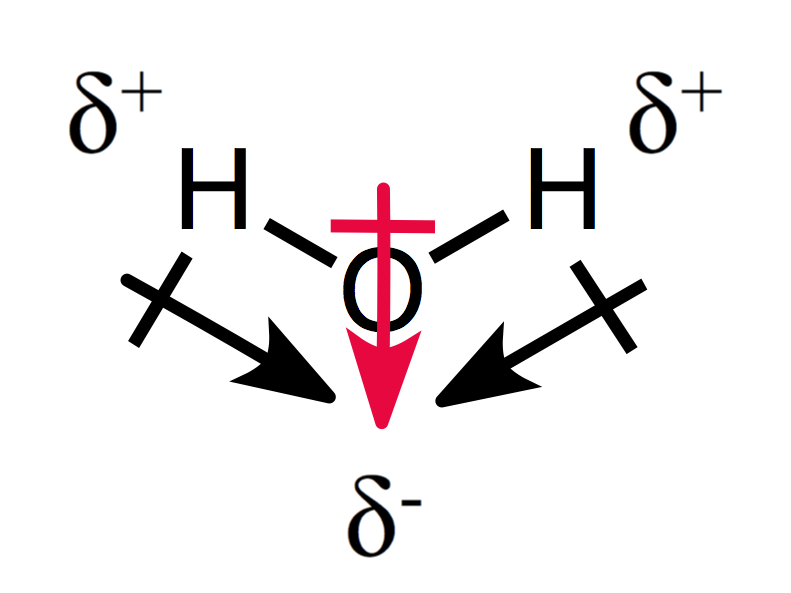
De to dipol øyeblikk legg til hverandre for å skape en samlet dipolmoment, og dermed en polar-molekylet.,
Som en konklusjon, for å forutsi et molekyl er polaritet, må du være kjent med Lewis strukturer, electronegativity, VSEPR-Teorien, og bond polaritet.