Mål
Ved slutten av denne delen, vil du være i stand til å:
- Beskrive hvordan elektroner ble oppdaget.
- Forklare Millikan olje slippe eksperiment.
- Beskrive Rutherford gull folie eksperiment.
- Beskrive Rutherford er planetarisk modell av atomet.
Akkurat som atomene er en understruktur av saken, elektroner og kjerner er underlag av atom., Forsøkene som ble brukt til å oppdage elektroner og kjerner avsløre noen av de grunnleggende egenskaper til atomer og kan være lett forstått ved å bruke slike ideer som elektrostatisk og magnetisk kraft, som allerede er dekket i tidligere kapitler.
Gebyrer og Elektromagnetiske Krefter
I tidligere diskusjoner, vi har lagt merke til at positive ladningen er forbundet med kjerner og negativ ladning med elektroner. Vi har også omfattet mange aspekter av elektriske og magnetiske krefter som påvirker kostnader., Vi vil nå utforske oppdagelsen av elektronet og kjernen som underlag av atom og undersøke deres bidrag til egenskaper til atomer.
Electron

Figur 1. Et gassutslipp rør lyser når en høy spenning til det. Elektroner avgis fra katoden er akselerert mot anoden, de stimulerer atomer og molekyler i gassen, som lyser i respons., En gang kalt Geissler rør og senere Crookes rør, de er nå kjent som cathode-ray-rør (CRTs) og er funnet i eldre Tv-er, pc-skjermer, og x-ray maskiner. Når et magnetisk felt er anvendt, stråle-svinger i retning forventet for negativ ladning. (credit: Paul Downey, Flickr)
gassutslipp rørene, slik som vist i Figur 1, består av en evakuert glass rør som inneholder to metall elektroder og en rarefied gass. Når en høy spenning til elektrodene, gassen lyser. Disse rørene var forløperne til dagens neonlys., De ble først studert på alvor av Heinrich Geissler, en tysk oppfinner og glassblåser, som starter i 1860-årene. Den engelske forskeren William Crookes, blant andre, fortsatte å studere hva for noen tid ble kalt Crookes rør, hvor er frigjort elektroner fra atomer og molekyler i rarefied gass i røret og blir akselerert fra katoden (negative) til anoden (positive) av potensialet., Disse «cathode stråler» kolliderer med gass atomer og molekyler og opphisset, noe som resulterer i utslipp av elektromagnetiske (EM) stråling som gjør at elektroner’ bane synlig som en stråle som sprer seg og forsvinner når den beveger seg bort fra katoden.
gassutslipp rørene i dag er de fleste ofte kalt cathode-ray-rør, fordi den stråler kommer til katoden. Crookes viste at elektroner bære momentum (de kan gjøre en liten padle hjulet rotere)., Han fant også at deres normalt rett bane er bøyd av en magnet i den retning som forventes for en negativ ladning i bevegelse bort fra katoden. Dette var den første direkte indikasjoner på elektroner og sine kostnader.

Figur 2. J. J. Thomson (kredittkort: www.firstworldwar.com, via Wikimedia Commons)
Den engelske fysikeren J. J. Thomson (1856-1940) forbedret og utvidet omfanget av eksperimenter med gassutslipp rør. (Se Figur 2 og Figur 3., Han bekreftet negativ ladning av katoden stråler med både magnetisk og elektrisk felt. I tillegg samlet han inn stråler i en metall-cup og fant et overskudd av negativ ladning. Thomson var også i stand til å måle forholdet mellom kostnad av elektronet til sin masse, \frac{q_e}{m_e}\\—et viktig skritt for å finne den faktiske verdier av både qe og meg. Figur 4 viser en cathode-ray tube, som produserer en smal stråle av elektroner som passerer gjennom lading plater som er koblet til en høyspent strømforsyning., Et elektrisk felt E er produsert mellom lading plater, og cathode-ray tube er plassert mellom polene av en magnet, slik at det elektriske feltet E er vinkelrett på magnetfeltet B av magneten. Disse feltene, blir vinkelrett på hverandre, produsere motstridende krefter på elektroner. Som diskutert for masse spektrometer i Flere Programmer av Magnetisme, hvis netto kraft på grunn av feltene forsvinner, så hastigheten av ladet partikkel er v=\frac{E}{B}\\., På denne måten, Thomson bestemmes hastigheten til elektronene og deretter flyttet strålen opp og ned ved justering av det elektriske feltet.

Figur 3. Diagram av Thomson ‘ s CRT. (credit: Kurzon, Wikimedia Commons)

Figur 4. Dette skjematisk viser electron beam i en CRT passerer gjennom krysset elektriske og magnetiske felt og forårsaker fosfor til å gløde når slående enden av røret.
Gathering vilkår, har vi \frac{q_e}{m_e}=\frac{a}{E}\\.,
Hva er så viktig om \frac{q_e}{m_e}\\, forholdet mellom elektronets kostnad for masse? Verdien er innhentet
\displaystyle\frac{q_e}{m_e}=-1.76\times10^{11}\text{ D/kg (elektron)}\\
Dette er et stort antall, som Thomson realisert, og det innebærer at elektronet har en svært liten masse. Det var kjent fra galvanisering at om lag 108 C/kg er nødvendig for å platen et materiale, en faktor på ca 1000 mindre enn kostnad per kilo av elektroner., Thomson gikk på å gjøre det samme eksperimentet for positivt ladet hydrogen ioner (nå kjent for å være nakne protoner) og fant en kostnad per kilo om 1000 ganger mindre enn for electron, noe som tyder på at proton er ca 1000 ganger mer massiv enn elektronet. I dag vet vi mer presist at
\displaystyle\frac{q_p}{m_p}=9.58\times10^{7}\text{ D/kg (proton)}\\,
hvor qp er ansvarlig for proton og mp er massen sin. Dette forholdet (fire viktige tall) er 1836 ganger mindre kostnad per kilo enn for elektronet., Siden kostnadene av elektroner og protoner er lik i størrelse, dette innebærer mp = 1836me.
Thomson utført en rekke eksperimenter ved hjelp av ulike gasser i utslipp av rør og bruke andre metoder, for eksempel fotoelektrisk effekt, for å frigjøre elektroner fra atomer. Han har alltid funnet de samme egenskapene for electron, beviser det å være en uavhengig partikkel. For sitt arbeid, er det viktig stykker som han begynte å publisere i 1897, Thomson ble tildelt 1906 nobelprisen i Fysikk., I ettertid er det vanskelig å sette pris på hvor utrolig det var å finne at atomet har en understruktur. Thomson selv sa, «Det var bare når jeg var overbevist om at eksperimentet venstre ikke kan flykte fra det som jeg publiserte min tro på eksistensen av organer som er mindre enn atomer.»
Thomson forsøkt å måle belastningen på enkelte elektroner, men hans metode kunne bestemme sin kostnad bare for å størrelsesorden forventet.
Siden Faraday ‘ s eksperimenter med galvanisering i 1830-årene, det hadde blitt kjent at om lag 100.000 C per mole var nødvendig for å plate enkeltvis ionisert ioner., Å dele dette med antall ioner per mole (som er, av Avogadro nummer), som var ca kjent, kostnad per ion ble beregnet til å være ca 1,6 × 10-19 C, i nærheten av den faktiske verdien.

Figur 5. Robert Millikan (credit: Ukjent Forfatter, via Wikimedia Commons)
En Amerikansk fysiker, Robert Millikan (1868-1953) (se Figur 5), besluttet å forbedre Thomson ‘ s eksperiment for å måle qe og ble til slutt tvunget til å prøve en annen tilnærming, som nå er et klassisk eksperiment utført av studenter., Den Millikan olje slippe eksperiment er vist i Figur 6.
I Millikan olje slippe eksperiment, fine dråper olje blir sprøytet fra en atomizer. Noen av disse er belastet av prosessen, og kan deretter bli suspendert mellom metall plater av en spenning mellom platene. I denne situasjonen, vekten av drop er balansert av elektrisk kraft:
m dropg = qe E

Figur 6., Den Millikan olje slippe eksperiment produsert den første nøyaktige direkte måling av belastning på elektroner, en av de mest fundamentale konstanter i naturen. Fine dråper av oljen bli belastet ved sprøyting. Deres bevegelser er observert mellom metall plater med en potensiell brukes til å motsette seg gravitasjonskraft. Balansen av gravitasjonsfelt og elektriske krefter tillater beregning av avgiften på en dråpe. Gebyret er funnet å være quantized i enheter av -1.6 × 10-19 C, og dermed bestemme direkte ansvarlig for det overskytende og manglende elektroner på olje synker.,
Det elektriske feltet er produsert av brukt spenning, derfor, E=\frac{V}{d}\\, og V er justert for å bare balansere slippe vekten. Dråpene kan bli sett på som poeng av reflektert lys ved hjelp av et mikroskop, men de er for små til å direkte måle deres størrelse og masse. Massen av drop bestemmes ved å observere hvor fort det faller når spenningen er slått av. Siden luftmotstand er svært viktig for disse submicroscopic faller, jo mer massiv dråper faller raskere enn de mindre massive, og sofistikert sedimentering beregninger kan avsløre deres masse., Olje er brukt i stedet for vann, fordi det ikke lett fordamper, og så massen er nesten konstant. Når massen av drop er kjent, ansvaret for elektronet er gitt ved å omorganisere den tidligere ligning:
\displaystyle{q}=\frac{m_{\text{slippe}}g}{E}=\frac{m_{\text{slippe}}gd}{V}\\,
der d er avstanden av platene og V er den spenningen som har drop urørlig. (Samme slipp kan observeres i flere timer for å se at det virkelig er ubevegelig.,) Av 1913 Millikan hadde målt ansvaret for elektronet qe med en nøyaktighet på 1%, og han forbedret dette med en faktor på 10 i løpet av et par år til en verdi av -1.60 × 10-19 C. Han har også observert at alle kostnader ble flere av de grunnleggende electron lade og at plutselige endringer kan skje i elektroner som ble lagt til eller fjernet fra drops. For dette veldig grunnleggende direkte måling av qe og for hans studier av fotoelektrisk effekt, Millikan ble tildelt 1923 nobelprisen i Fysikk.,
Med ansvar for elektronet kjent og gratis-til-masse forholdet kjent, elektronets masse kan beregnes. Det er
\displaystyle{m}=\frac{q_e}{\left(\frac{q_e}{m_e}\right)}\\
Erstatter kjente verdier gir
\displaystyle{m}_e=\frac{-1.60\times10^{-19}\text{ D}}{-1.76\times10^{11}\text{ D/kg}}\\
eller meg = 9.11 × 10-31 kg (elektronets masse), hvor de runde av feil har blitt rettet opp., Massen til elektronet har blitt bekreftet i mange påfølgende eksperimenter og er nå kjent med en nøyaktighet på bedre enn en del i en million. Det er en utrolig liten masse, og er fortsatt den minste kjent masse av partikler som har masse. (Noen partikler, for eksempel fotoner, er massless og kan ikke bringes til å hvile, men reiser på lysets hastighet.) En lignende beregning gir masser av andre partikler, inkludert proton. Tre sifre, massen av proton er nå kjent for å være mp = 1.67 × 10-27 kg (proton masse), som er nesten helt identiske med den masse av et hydrogenatom., Hva Thomson og Millikan hadde gjort, var å bevise eksistensen av en understruktur av atomer, elektronet, og videre å vise at den hadde bare en liten del av massen av et atom. Kjernen av et atom inneholder det meste av sin masse, og arten av kjernen var helt uventet.
en Annen viktig karakteristikk av kvantemekanikken var også begynner å dukke opp. Alle elektronene er identiske med hverandre. Lade-og masse av elektroner er ikke gjennomsnittlige verdier; i stedet, de er unike verdier som alle elektronene har., Dette er sant for andre fundamentale enheter på submicroscopic nivå. Alle protoner er identisk med en annen, og så videre.
Kjernen
Her vil vi se på det første direkte bevis på størrelse og masse av kjernen. I senere kapitler vil vi undersøke mange andre aspekter av kjernefysikk, men den grunnleggende informasjonen om kjernefysisk størrelse og masse er så viktig å forstå atom at vi anser det her.
Kjernefysiske radioaktivitet ble oppdaget i 1896, og det ble snart gjenstand for intens studie av en rekke av de beste forskerne i verden., Blant dem var New Zealandsk Herren Ernest Rutherford, som har gjort mange fundamentale oppdagelser og fikk tittelen «far kjernefysikk.»Født i Nelson, Rutherford gjorde sin videreutdanning i Cavendish Laboratorier i England før du tar opp en stilling ved McGill University i Canada, hvor han arbeidet som ga ham nobelprisen i Kjemi i 1908. I området av atom-og kjernefysikk, det er mye overlapp mellom kjemi og fysikk, med fysikk å gi grunnleggende aktivere teorier., Han kom tilbake til England i senere år og hadde seks fremtiden nobelprisvinnere som studenter. Rutherford brukt kjernefysisk stråling direkte undersøke størrelsen og masse av atomkjernen. Eksperimentet han utviklet er vist i Figur 7. En radioaktiv kilde som sender ut alfa-stråling ble plassert i en leder beholder med et hull i den ene siden for å produsere en bredde av alfa-partikler, som er en type ioniserende stråling kastet ut av kjerner av en radioaktiv kilde., En tynn gull folie ble plassert i bredde og spredning av alfa-partikler ble observert av gløden de forårsaket når de traff en fosfor skjermen.

Figur 5. Rutherford ‘ s eksperiment ga direkte bevis for størrelse og masse av kjernen ved spredning alfa-partikler fra en tynn gull folie. Alfa-partikler med energier av om 5MeV slippes ut fra en radioaktiv kilde (som er en liten metall beholder hvor en bestemt mengde av et radioaktivt materiale er forseglet), er collimated i en bjelke, og falle på folien., Antall partikler som trenger inn i folie eller scatter til ulike vinkler indikerer at gull kjerner er svært små og inneholder nesten alle av gull atom masse. Dette er spesielt angitt av alfa-partikler som scatter til svært store vinkler, mye som en fotball ballen sprette av en keeper ‘ s head.,
Alfa-partikler var kjent for å være dobbelt belastet positive kjerner av helium atomer som hadde kinetiske energier på rekkefølgen av 5 MeV når slippes ut i kjernefysiske forfall, som er oppløsningen av kjernen i en ustabil nuclide av spontan emisjon av partikler. Disse partiklene samhandle med saken for det meste via Coulomb kraft, og på hvilken måte de scatter fra atomkjerner kan avsløre kjernefysiske størrelse og masse. Dette er analogt til å observere hvordan en bowling ball er spredt av et objekt, kan du ikke se direkte., Fordi alpha partikkel energi er så stor sammenlignet med typiske energier forbundet med atomer (MeV versus eV), ville du forvente at alfa-partikler, for å rett og slett krasjer gjennom en tynn folie mye som en supersonisk bowling ballen ville krasje gjennom et par dusin rader av bowlingkjegler. Thomson hadde tenkt atom til å være en liten sfære som like mengder av positiv og negativ ladning ble jevnt fordelt. Hendelsen massive alfa-partikler ville lide bare små deflections i en slik modell., I stedet, Rutherford og hans medarbeidere funnet at alfa-partikler noen ganger ble spredt til store vinkler, noen til og med tilbake i den retning som de kom! Detaljert analyse med bevaring av bevegelsesmengde og energi—spesielt i lite antall som kom rett tilbake—underforstått at gull kjerner er svært liten sammenlignet med størrelsen av en gull-atom, inneholder nesten alle av atom masse, og er tett bundet. Siden gull kjernen er flere ganger mer massiv enn alfa-partikkel, en head-on kollisjon ville scatter-alfa-partikkel rett tilbake mot kilden., I tillegg er det mindre kjernen, jo færre alfa-partikler som ville treffe ett hode på.
Selv om resultatene av eksperimentet ble publisert av hans kolleger i 1909, og det tok Rutherford to år å overbevise seg selv om deres betydning. Som Thomson før ham, Rutherford var villige til å akseptere en slik radikal resultater. Naturen på en liten skala er så ulik vår klassiske verden at selv de som i forkant av discovery er noen ganger overrasket. Rutherford skrev senere: «Det var nesten like utrolig som om du skjøt en 15-tomme skall på et stykke tørkepapir og den kom tilbake og traff deg., På vederlag, skjønte jeg at dette sprer seg bakover . . . . . . den største delen av massen til atomet var konsentrert i en liten kjerne.»
I 1911, Rutherford publisert sin analyse sammen med en foreslått modell av atomet. Størrelsen på kjernen var fast bestemt på å være ca 10-15 m, eller 100 000 ganger mindre enn et atom. Dette innebærer en stor tetthet, på ordre fra 1015 g/cm3, vesentlig i motsetning til alle makroskopiske saken. Også indirekte er eksistensen av tidligere ukjente kjernefysiske styrker for å motvirke den store frastøtende Coulomb styrker blant de positive ladninger i kjernen., Store styrker ville også være i tråd med de store krefter som slippes ut i kjernefysisk stråling.

Figur 8. En utvidet visning av atomene i gull folie i Rutherford ‘ s eksperiment. Sirklene representerer atomer (ca 10-10 m i diameter), mens prikkene representerer kjerner (ca 10-15 m i diameter). For å være synlig, prikkene er mye større enn skala. De fleste alfa-partikler krasje gjennom, men er relativt upåvirket grunn av sin høye energi, og elektronet er liten masse., Noen, men hodet rett mot en kjerne og er spredt rett tilbake. En detaljert analyse gir størrelse og masse av kjernen.
Den lille størrelsen av kjernen medfører at atomet er for det meste tom på innsiden. Faktisk, i Rutherford ‘ s eksperiment, mest alphas gikk rett gjennom gull folie med svært liten spredning, siden elektroner har slike små massene og siden atom var for det meste tomt med noe for alpha å treffe., Det var allerede hint av dette på den tiden Rutherford utført sine eksperimenter, siden energiske elektroner hadde blitt observert å trenge tynn foils lettere enn forventet. Figur 8 viser en skjematisk av atomer i en tynn folie med sirkler som representerer størrelsen på atomer (ca 10-10 m) og punkter som representerer kjerner. (Prikkene er ikke i skala—hvis de var det, ville du trenger et mikroskop for å se dem.) De fleste alfa-partikler gå glipp av de små kjerner og er bare litt spredt av elektroner., Noen ganger, (omtrent en gang i 8000 ganger i Rutherford ‘ s eksperiment), en alfa treffer en kjerne head-on og er spredt rett bakover.

Figur 9. Rutherford er planetarisk modell av atomet inneholder egenskapene til kjernen, elektroner, og størrelsen på et atom. Denne modellen var den første til å gjenkjenne strukturen av atomer, som i lav-masse elektroner i bane rundt en svært liten, massive kjernen i baner som er mye større enn kjernen. Atom er for det meste tomme og er analogt til våre planetariske systemet.,
Basert på størrelse og masse av kjernen avslørt av hans eksperiment, så vel som massen av elektroner, Rutherford foreslo planetarisk modell av atomet. Den planetarisk modell av atomet bilder lav masse og elektroner som går i bane rundt en stor masse kjernen. Størrelsen på elektron i bane er stor sammenlignet med størrelsen på kjernen, med det meste vakuum inne i atomet. Dette bildet er analogt til hvordan lav masse og planetene i vårt solsystem bane stor-masse Sol om avstanden er stor sammenlignet med størrelsen på solen., I atomet, attraktive Coulomb force er analogt til gravitasjon i den planetariske systemet. (Se Figur 9.) Vær oppmerksom på at en modell eller mentalt bilde er nødvendig for å forklare eksperimentelle resultater, siden atom er for små til å være direkte observert med synlig lys.
Rutherford er planetarisk modell av atomet var avgjørende for å forstå egenskapene til atomer, og deres interaksjoner og energier, som vi skal se i de neste seksjonene. Det ble også en indikasjon på hvordan ulike arten er fra den kjente klassiske verden på den lille, kvantemekaniske skala., Oppdagelsen av en underlaget all materie i form av atomer og molekyler blir nå tatt et steg videre for å avsløre en understruktur av atomer som var enklere enn 92 elementer så kjent. Vi fortsatte med å lete etter en dypere underlag, slik som de som er inne i kjernen, med en viss suksess. I senere kapitler vil vi følge denne søken i diskusjonen av kvarker og andre elementære partikler, og vi vil se i den retningen du søke synes nå å være på vei.,
PhET Undersøkelser: Rutherford Spredning
Hvordan fikk Rutherford finne ut den struktur av atom-uten å være i stand til å se det? Simulere den berømte eksperiment der han avkreftet den Plum Pudding modell av atomet ved å observere alfa-partikler sprette av atomer og bestemme at de skal ha en liten kjerne.
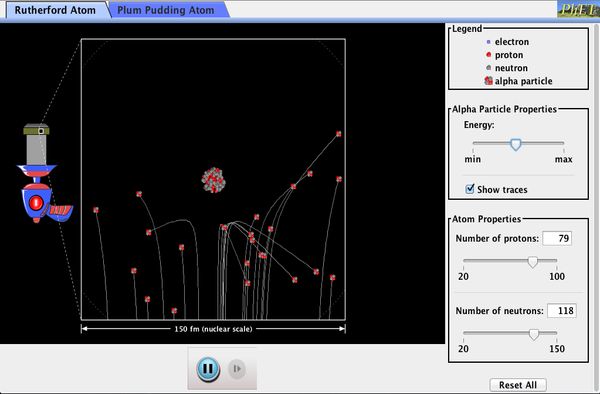
Klikk for å laste ned simulering. Kjør ved hjelp av Java.,
– Delen Oppsummering
Problemer & Øvelser
- Rutherford fant størrelsen på kjernen til å være ca 10-15 m. Dette førte til en stor tetthet. Hva ville dette være tetthet for gull?
- I Millikan olje-slipp-eksperiment, man ser på en liten dråpe olje holdt urørlig mellom to plater. Ta spenningen mellom platene for å bli 2033 V, og platen separasjon å være 2.00 cm. Olje-drop (tetthet 0.81 g/cm3) har en diameter på 4,0 × 10-6 m. Finn pris på å slippe, i form av elektron-enheter.,
- (a) En fremadstormende fysiker ønsker å bygge en skala modell av et hydrogenatom for henne science fair prosjekt. Hvis atomet er 1,00 m i diameter, hvor stor skal hun prøve å gjøre kjernen? (b) Hvor lett vil dette være å gjøre?