OSS Pharm. 2020;45(9):27-29.
ABSTRAKT: Siden syntetiske hormoner først ble kombinert i 1940-årene, hormone erstatning terapi har vært mye brukt av kvinner som opplever uønsket menopausal symptomer. Senere forskning førte til funn av flere negative effekter forbundet med bruk av hormonbehandling, sparking diskusjoner om risiko versus fordeler av hormonell behandling., På grunn av den risiko som er forbundet med kommersielle preparater, forsterket hormonbehandling (CHT) har blitt mer fremtredende, som det har vært spioneringen som en biologisk tilsvarende alternativ til syntetiske hormoner. Imidlertid, på grunn av minimal eller ingen FDA tilsyn i compounding verden generelt, CHT kan ikke være så trygg som har blitt annonsert. I 2018, basert på gunstige rettssaken resultater, Bijuva ble den første FDA-godkjent bioidentical kombinasjon 17-beta-østradiol-progesteron formulering.,
For flere tiår, kvinner har slått til hormone erstatning terapi for å behandle ugunstig vasomotor symptomer forbundet med overgangsalderen, som hetetokter og nattesvette. Kvinner kan bruke opp til en tredjedel av sitt liv i en hormon-mangelfull tilstand, noe som bidrar ytterligere til slike uønskede virkninger som humørsvingninger, økt risiko for osteoporose, og redusert libido. Systemisk østrogen er den mest effektive behandlingen for vasomotor symptomer, mens genitourinary symptomer forbundet med overgangsalderen bør behandles med lav-dose aktuelle østrogen.,1 observasjonell Studie av Kvinners Helse på Tvers av Nasjonen funnet at kvinner opplever vasomotor symptomer i gjennomsnitt 7.4 år innlegget overgangsalder.2 Men, de fleste leger anbefaler at behandlingen vare i ikke lenger enn 5 år innlegget overgangsalder og anbefaler å unngå hormonbehandling helt i kvinner eldre enn fylte 60 år.1 klinikeren bør nøye veie risiko og fordeler forbundet med syntetisk og forsterket hormoner mens du holder i tankene det primære målet er å forbedre pasientens livskvalitet.,
Bioidentical Hormon
Bioidentical hormoner, slik som østrogen, progestins, og androgener, er forbindelser som er utarbeidet i henhold til USP Kapittel <795> Nonsterile Compounding standarder. Disse hormonene kan bli forsterket i en rekke doser og dosering former, og skaper mange valg for kvinner som er interessert i forsterket hormonbehandling (CHT)., Forsterket formuleringer ikke gjennomgå strenge produksjon og renhet standarder for testing at deres FDA-godkjent kolleger gjør, men til tross for dette uregulert miljø, CHT er allment populær med pasienter som søker mer «personlig» medisin.
Det Endokrine Samfunnet har definert forsterket bioidentical hormon som «forbindelser som har samme kjemiske og molekylær struktur som er hormoner som produseres i kroppen.,»3 FDA hevder at begrepet bioidentical hormon er rent en markedsføringsstrategi, så det er ikke noe vitenskapelig grunnlag for en ubetinget fordel eller risiko reduksjon for CHT over FDA-godkjent syntetisk hormon terapi.3
Syntetisk Hormon Terapi
FDA godkjent diethylstilbestrol i 1941 og conjugated equine estrogens (CEE) i 1942 for å behandle menopausal symptomer.4 Start på 1960-tallet, østrogen salget eksplodert frem til 1975, da rapporter dukket opp at østrogen bruk kan være forbundet med en økt risiko for livmorkreft.,4 Men disse rapportene ble i stor grad ignorert, og østrogen bruk fortsatte. Ikke før i 1996, da Postmenopausale Østrogen/Gestagen Intervensjoner (PEPI) studie ble publisert, gjorde helsepersonell begynner å virkelig forstå de potensielle negative effekter forbundet med østrogen behandling. PEPI var et 3-årig randomisert, placebo-kontrollert, dobbelt-blind, multisenter-rettssaken at undersøkt histologic endometrisk effekter av behandling med syntetiske uten motstand østrogen mot tre ulike regimer av syntetisk østrogen pluss gestagen.,5
I PEPI rettssaken, betydelig flere fag østrogen gitt alene utviklet enkle og komplekse, eller atypisk endometriehyperplasi versus fag gitt placebo (TABELL 1). Videre, mens den nøyaktige prosenter var ikke spesifisert, priser av hyperplasia i fag gis en av de tre østrogen-plus-progestin regimer var lik de i fag gitt placebo.5 I sammendraget, administrasjon av østrogen alene i en dose på 0.,625 mg per dag ført til en betydelig økt forekomst av endometriehyperplasi, mens kombinere CEE med progestin beskyttet endometrium fra overvekst i en betydelig grad.5 på Grunn av dette bevist endometrisk-kreft risiko, progestin er alltid gitt i kombinasjon med østrogen hos kvinner med intakt uterus. Videre bekrefter denne risikoen, 2007-saken serien beskrevet tre kvinnene som brukte CHT inneholder subtherapeutic doser av gestagen og senere utviklet livmorkreft.,6
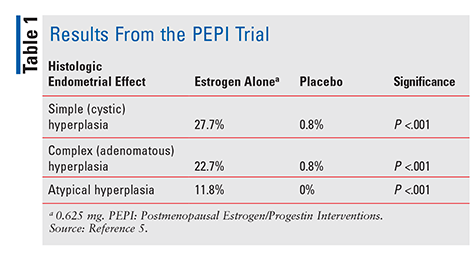
PEPI rettssaken, sammen med resultater på 16,068 postmenopausale kvinner fra Women ‘ s Health Initiative (WHI) publisert i 2002, og kaste lys på de alvorlige bekymringer reist på 1970-tallet.7 Selv om det PEPI forsøket viste ingen økt risiko for hyperplasi med kombinasjonen produkt, som VI fant signifikant økt risiko forbundet med syntetisk hormon bruk, slik som hjerte-og karsykdommer, hjerneslag, tromboemboliske hendelser, og brystkreft.,7 Det var en 80% økt risiko for hjerte-og karsykdommer på 1 år etter seponering av kombinasjonen CEE/medroxyprogesterone acetat terapi, og en 37% økt risiko for hjerneinfarkt under inngrepet fase med kombinasjonsbehandling. Også, bryst-kreft risiko var betydelig økt (24%) i løpet av intervensjonen. Østrogen-plus-progestin bruke gjorde gi noen fordeler, med pasienter merke seg en redusert forekomst av vaginal atrofi, redusert vasomotor symptomer som hetetokter og nattesvette, og en 38% redusert risiko for kolorektal kreft under behandling med kombinasjon terapi.,7 Likevel, på grunn av betydningen av den økte risikoen for brystkreft og tromboemboliske hendelser, rettssaken ble stoppet tidlig.
Forsterket hormonbehandling
Den risiko som er diskutert ovenfor banet vei for CHT advokatvirksomhet fordi det ble antatt at skreddersøm eller tilpasse CHT til den enkelte pasient ville maksimere nytte og minimere risiko. Hevder at CHT ble tryggere og biologisk vennligere ble mer fremtredende, og bruken økte., Pinkerton og Santoro brukt to ulike undersøkelser—Harris og Steg—for å vurdere pasientenes kunnskap om CHT og kvantifisere bruk av CHT versus FDA-godkjent hormonbehandling, henholdsvis.8 Resultater av Harris-undersøkelsen viste at 86% av kvinner i alderen 40 til 65 år var uvitende om at CHT var ikke en FDA-godkjent, og ekstrapolert resultater av Rose-undersøkelsen antydet at årlig, opp til 2,5 millioner kvinner eldre enn 40 år år kan bruke CHT.8 Data fra begge undersøkelsene indikerte at en lege eller apotek hadde anbefalt CHT., Disse resultatene tyder på at muligheten eksisterer for tilbydere for å sikre at pasientene er informert om produktet de mottar, inkludert alle risikoer forbundet med hormonbehandling, og for compounding farmasøyter for å sikre at de leverer en terapeutisk rent produkt som pasienter kan stole på.
Fordi FDA er ikke ansvarlig for standardisering av forsterket produkter, regulering ofte faller til staten boards of pharmacy., Disse styrene vanligvis ikke har ressurser til å gjennomføre regelmessige inspeksjoner av compounding apotek, og FDA griper bare når en klage er gjort.9 Selv om forsterket formuleringer er ikke juridisk forpliktet til å bære risiko advarsler, teoretisk disse produktene kan utgjøre den samme risiko som de som er nevnt ovenfor for syntetisk hormon terapi. Til dags dato, har det imidlertid ikke vært head-to-head sikkerhet studier av CHT versus syntetiske hormoner.,10
Det er tre typer estrogens en kvinne kan få som en del av en forsterket hormon erstatning diett: østron (E1), østradiol (E2), og estriol (E3), som hver har en varierende grad av styrke (E2 > E1 > E3).9 Fordi de kjemper for den samme reseptoren, disse estrogens fungere som konkurransedyktig hemmere, noe som resulterer i redusert effekt dersom ikke riktig balansert.,11 Derfor tilhengere av CHT utviklet Biest (E2 + E3 i en 20/80 formulering) og Trieste (E1 + E2 + E3 i en 10/10/80 formulering) for å maksimere fysiologisk styrke, men det finnes for øyeblikket ingen bevis som støtter påstanden om at disse formuleringene i disse prosenter gi noen sikkerhet fordel sammenlignet med syntetisk hormon terapi.11
Selv om det i det hele CHT har vært mangelfullt studert og uregulert, i oktober 2018, basert på funn fra de FYLLE rettssaken, Bijuva ble den første FDA-godkjent bioidentical kombinasjon 17-beta-østradiol-progesteron formulering., FYLLE, en fase III, randomisert, dobbelt-blind, placebo-kontrollert, multisenter-studien undersøkte effekten, livmorkreft sikkerhet, og generelle sikkerhet av fire ulike doser av en enkelt 17-beta-østradiol-progesteron kapsel for moderat til alvorlig vasomotor symptomer hos postmenopausale kvinner.12 Den primære sikkerhet endepunkt var forekomsten av endometriehyperplasi på 12 måneder. Ved 12 måneder, ingen tilfeller av endometriehyperplasi ble observert for noen av østradiol-progesteron dosering formuleringer.,12 I 12 uker, østradiol 1 mg progesteron 100 mg formulering vist den største statistisk signifikant reduksjon i vasomotor symptom hyppigheten og alvorlighetsgraden sammenlignet med placebo og samtidig opprettholde primære sikkerhet-endepunkt standarder.12 Men, som tidligere nevnt, det har vært noen forsøk for å sammenligne sikkerheten av syntetiske hormoner versus bioidentical hormon formuleringer, så teoretisk risiko forbli.,
Konklusjon
Basert på FYLLE rettssaken, pre-, peri-og postmenopausale kvinner har nå et standardisert, regulert, bioidentical, FDA-godkjente behandling for vasomotor symptomer. Fremtidige studier er nødvendig for å fullt avgrensning av sikkerhet profil av 17-beta-østradiol og CHT. Farmasøyter bør anbefale noen p-hormon formulering for den korteste varighet mulig., I tillegg, hvis CHT er valgt, farmasøyter bør sikre at deres pasienter vet hva CHT er og hvordan det skiller seg fra syntetiske hormoner, mens også ha en åpen samtale om fordeler og risiko av hormone erstatning terapi.
1. Martin KA Manson JE. Tilnærming til pasienten med menopausale symptomer. J Clin Endocrinol Metab. 2008;93(12):4567-4575.
2. Avis NE, Crawford SL, Greendale G, et al. Varigheten av menopausal vasomotor symptomer over overgangsalderen overgang. JAMA Interne Med. 2015;175(4):531-539.
3. Santoro N, Braunstein GD, Rumper CL, et al., Forsterket bioidentical hormon i endokrinologi praksis: en Endokrine Samfunnet vitenskapelig uttalelse. J Clin Endocrinol Metab. 2016;101(4):1318-1343.
4. Stefanick ML. Estrogens og progestins: bakgrunn og historie, trender i bruk, og retningslinjer og regimer som er godkjent av US Food and Drug Administration. Am J Med. 2005;118(suppl 12B):64-73.
5. Skrivegruppa for PEPI Rettssaken. Virkninger av hormone erstatning terapi på endometrisk histology i postmenopausal kvinner. Det Postmenopausale Østrogen/Gestagen Intervensjoner (PEPI) Rettssaken. JAMA. 1996;275(5):370-375.
6., Eden JA, Hacker NF, Formue M. Tre tilfeller av livmorkreft forbundet med «bioidentical» hormone replacement therapy. Med J Aust. 2007;187(4):244-245.
7. Rossouw JE, Anderson GL, Prentice RL, et al. Risiko og fordeler av østrogen pluss gestagen i sunn postmenopausale kvinner: rektor resultater fra Women ‘ s Health Initiative randomized controlled trial. JAMA. 2002;288(3):321-333.
– 8. Pinkerton JV, Santoro N. Forsterket bioidentical hormon terapi: identifisere bruk trender og kunnskapsmangler blant OSS kvinner. Overgangsalder. 2015;22(9):926-936.
9. Bhavnani BR, Stanczyk FZ., Misforståelse og bekymringer om bioidentical hormon som brukes for tilpasset forsterket hormonbehandling. J Clin Endocrinol Metab. 2012;97(3):756-759.
10. Bijuva (østradiol og progesteron) pakningsvedlegget. Boca Raton, FL: TherapeuticsMD, Inc; November 2019.
11. Kuhl H. Farmakologi av østrogen og gestagen: påvirkning av forskjellige ruter av administrasjonen. Climacteric. 2005;8(suppl 1):3-63.
12. Lobo RA, Archer DF, Kagan R, et al. En 17beta-østradiol-progesteron oral kapsel for vasomotor symptomer hos postmenopausale kvinner: en randomisert, kontrollert studie. Obstet Gynecol., 2018;132(1):161-170.
innholdet i denne artikkelen er bare til informasjonsformål. Innholdet er ikke ment å være en erstatning for profesjonell rådgivning. Det å stole på noen informasjon som er gitt i denne artikkelen er utelukkende under din egen risiko.