membranproteiner
Mens lipider er den grunnleggende strukturelle elementer av membraner, proteiner er ansvarlig for gjennomføring av konkrete membran funksjoner. De fleste plasma-membraner består av ca 50% lipid og 50% protein etter vekt, med karbohydrat deler av glycolipids og glycoproteins utgjør 5 til 10% av membranen masse. Siden proteiner er mye større enn lipider, denne andelen tilsvarer om lag ett protein molekyl per hver 50 til 100 molekyler av lipid., I 1972, Jonathan Sanger og Garth Nicolson foreslått væsken mosaikk modell av membranen struktur, som nå er allment akseptert som den grunnleggende paradigme for organisering av alle biologiske membraner. I denne modellen, membraner blir sett på som to-dimensjonale væsker som proteiner er satt inn i lipid bilayers (Figur 12.3).

Figur 12.3
Væske mosaikk modell av plasma membran., Integrert membran proteiner er satt inn i lipid bilayer, mens perifer proteiner er bundet til membranen indirekte av protein-protein interaksjoner. De fleste integrert membranproteiner er en av verdens (mer…)
Sanger og Nicolson skilles i to klasser av membran-assosierte proteiner, som de kalles perifer og integrert membranproteiner., Perifer membranproteiner var operasjonelt definert som proteiner som tar avstand fra membranen følgende behandlinger med polar reagenser, for eksempel løsninger på ekstreme pH eller høy salt konsentrasjon, som ikke forstyrre fosfolipid bilayer. Når dissosiert fra membranen, perifer membranproteiner er løselig i vandige-bufferen. Disse proteinene er ikke satt inn i den hydrofobe interiør av lipid bilayer. I stedet er de indirekte forbundet med membraner gjennom protein-protein interaksjoner., Disse vekselsvirkningene ofte involverer ioniske bindinger, som er forstyrret av ekstreme pH eller høy salt.
I motsetning til de perifere membranproteiner, integrert membran protein kan være utgitt bare ved behandlinger som forstyrrer phospholipid bilayer. Deler av disse integrert membran proteiner er satt inn i lipid bilayer, slik at de kan være dissosiert bare av reagenser som forstyrrer hydrofobe interaksjoner., De mest brukte reagenser for solubilization av integrert membranproteiner er vaskemidler, som er små amphipathic molekyler som inneholder både hydrofobe og hydrofile grupper (Figur 12.4). Den hydrofobe deler av vaskemidler fortrenge membran lipider og binder seg til den hydrofobe deler av integrert membranproteiner. Fordi den andre enden av vaskemiddel molekylet er hydrofile, rengjøringsmiddel-protein komplekser er løselig i vandige løsninger.

Figur 12.4
Solubilization av integrert membranproteiner av vaskemidler., Vaskemidler (f.eks., octyl glukosid) er amphipathic molekyler som inneholder hydrofile hodet grupper og hydrofobe haler. Den hydrofobe haler binder seg til den hydrofobe deler av integrert membran (mer…)
Mange integrert proteiner er en av verdens proteiner, som spenner lipid bilayer med deler eksponert på begge sider av membranen. Disse proteinene kan bli visualisert i electron mikrografer av plasma membran som er utarbeidet av fryse-brudd teknikk (se Figur 1.35). I disse prøvene, membranen er delt og skiller i sine to brosjyrer., Verdens proteiner er så åpenbar som partikler på de interne sidene av membranen (Figur 12.5).

Figur 12.5
Fryse-brudd electron micrograph av menneskelig rødt blod celle membraner. Partikler i membranen er en av verdens proteiner. (Harold H. Edwards/Grafikk Ubegrenset.,)
membran-som spenner over deler av verdens proteiner er vanligvis α helices av 20 til 25 hydrofobe aminosyrer som er satt inn i membranen av endoplasmic reticulum under syntese av polypeptid-kjeden (se figur 9.11, 9.12 og 9.13). Disse proteinene blir deretter transportert i membranen blemmer fra endoplasmic reticulum til Golgi apparatet, og derfra til plasma membran., Karbohydrater grupper er lagt til polypeptid kjeder i både endoplasmic reticulum og Golgi apparatet, slik at de fleste av verdens proteiner i plasma membran er glycoproteins med sine oligosakkarider synlige på overflaten av cellen.
Studier av røde blod celler har gitt gode eksempler på både perifere og integrert proteiner forbundet med plasma membran. Membraner av menneskelig erytrocytter inneholder ca et dusin store proteiner, som opprinnelig ble identifisert ved gel elektroforese av membranen forberedelser., De fleste av disse er perifer membranproteiner som har blitt identifisert som komponenter av kortikal cytoskeleton, som ligger til grunn i plasma membran og bestemmer celle form (se Kapittel 11). For eksempel, den mest tallrike ytre membran protein av røde blodlegemer er spectrin, noe som er den største cytoskeletal protein av erytrocytter. Andre perifere membranproteiner av røde blodlegemer inkluderer actin, ankyrin, og bandet 4.1., Ankyrin fungerer som den viktigste koblingen mellom plasma membran og cytoskeleton ved binding til både spectrin og integrert membran protein band 3 (se Figur 11.11). En ekstra kobling mellom membran og cytoskeleton er gitt av bandet 4.1, som binder seg til veikryssene i spectrin og actin, samt å glycophorin (den andre store integrert membran protein av erytrocytter).
De to store integrert membranproteiner av røde blodlegemer, glycophorin og band 3, gir godt studert eksempler på transmembrane protein struktur (Figur 12.6)., Glycophorin er en liten glykoprotein av 131 aminosyrer, med en molekylvekt på ca 30,000, halvparten av disse er protein og halvparten karbohydrater. Glycophorin krysser membranen med en enkelt membran-som spenner over α-helix 23 aminosyrer, med sin glycosylated amino-terminal del eksponert på celleoverflaten. Selv om glycophorin var en av de første transmembrane proteiner til å bli preget, den presise funksjon er fortsatt ukjent. I kontrast, den funksjonen av de andre store er en av verdens protein av røde blodlegemer er godt forstått., Dette proteinet, opprinnelig kjent som band 3, er anion transportør ansvarlig for passering av bikarbonat (HCO3-) og klorid (Cl-) ioner over den røde blod celle membranen. Bandet 3 polypeptid-kjeden 929 aminosyrer og er antatt å ha 14 membran-som spenner over α-helical regioner. I membranen, dimers av band 3-form globular strukturer som inneholder interne kanaler gjennom hvilke ioner er i stand til å reise på tvers av lipid bilayer.
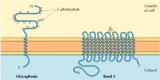
Figur 12.6
Integrert membranproteiner av røde blodlegemer., Glycophorin (131 aminosyrer) inneholder en eneste en av verdens α-helix. Det er tungt glyocosylated, med oligosakkarider festet til 16 sider på den ekstracellulære delen av polypeptid-kjeden. (mer…)
på Grunn av deres amphipathic karakter, er en av verdens proteiner har vist seg vanskelig å krystallisere, som er nødvendig for tre-dimensjonale strukturell analyse av røntgen-diffraksjon., Den første er en av verdens protein for å bli analysert av X-ray crystallography var den fotosyntetiske reaksjon sentrum av bakterien Rhodopseudomonas viridis, som har strukturen ble rapportert i 1985 (Figur 12.7). Reaksjonen center inneholder tre av verdens proteiner, utpekt L, M og H (lett, middels og tung) i henhold til deres tilsynelatende størrelser angitt ved gel elektroforese. L og M underenhetene hver har fem membran-spenner α helices. H subunit har bare en eneste en av verdens α-helix, med hoveddelen av polypeptid-kjeden på cytosolic side av membranen., Den fjerde subunit av reaksjonen center er et cytokrom, som er en ytre membran protein bundet til kompleks av protein-protein interaksjoner.

Figur 12.7
En bakteriell fotosyntetiske reaksjon center. Reaksjonen center består av tre av verdens proteiner, utpekt L (rød), M (gul) og H (grønn). L og M underenhetene hver har fem av verdens α helices, mens H subunit har bare (mer…)
Selv om de fleste av verdens proteiner span membranen av α-helical regioner, dette er ikke alltid tilfelle., Et godt preget unntak er gitt av porins—en gruppe proteiner som danner kanaler i ytre slimhinner i noen bakterier. Mange bakterier, blant annet E. coli, har en dobbel membran system der plasma membran (eller indre membranen) er omgitt av cellen vegg og en klar ytre membran (Figur 12.8). I motsetning til plasma membran, den ytre membran er svært gjennomtrengelig for ioner og små polare molekyler (i tilfelle av E. coli, med en molekylvekt opp til 600). Dette permeabilitet resultater fra porins, som danner åpne vandig tv gjennom lipid bilayer., Som omtalt i Kapittel 10, proteiner knyttet til bakteriell porins er også funnet i ytre slimhinner i mitokondrier og chloroplasts.
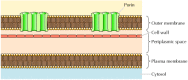
Figur 12.8
Bakteriell ytre slimhinner. Plasma membran av noen bakterier er omgitt av en cellevegg og en klar ytre membran. Den ytre membranen inneholder porins, som danner åpne vandig tv at gratis passering av ioner og små molekyler.
Strukturelle analyser har antydet at porins ikke inneholde hydrofobe α-helical regioner., I stedet, de krysser membranen som β fat, der 16 β ark kaste opp i en tønne-lignende struktur som omslutter en vandig pore (Figur 12.9). Sidekjeder av polare aminosyrer linje porene, mens sidekjeder av hydrofobe aminosyrer samhandle med innsiden av membranen. Den porin monomers knytte til å danne stabile trimers, som hver inneholder tre åpne kanaler som polare molekyler kan spre over membranen.

Figur 12.9
Strukturen av en porin monomer., Hver monomer er en β fat bestående av 16 antiparallel β tråder (piler). Den øverste enden av molekylet vender mot den eksterne medium. (Fra H. Nikaido, 1994. J. Biol. Kem. 269: 3905.)
I motsetning til verdens proteiner, et utvalg av proteiner (mange av dem oppfører seg som en integrert del av membranproteiner) er forankret i plasma membran ved kovalent bundet lipider eller glycolipids (Figur 12.10). Medlemmer av en klasse av disse proteinene er satt inn i den ytre pakningsvedlegget av plasma membran av glykosylfosfatidylinositol (GPI) ankere., GPI ankere er lagt til visse proteiner som har blitt overført til endoplasmic reticulum og er forankret i membranen av en C-terminal er en av verdens regionen (se Figur 9.16). Den er en av verdens regionen er spaltet som GPI anker er lagt til, slik at disse proteinene være festet til membranen bare av glycolipid. Siden polypeptid kjeder av GPI-forankret proteiner er overført til endoplasmic reticulum, de er glycosylated og synlige på overflaten av cellen følgende transport til plasma membran.
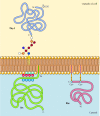
Figur 12.,10
Eksempler på proteiner forankret i plasma membran av lipider og glycolipids. Noen proteiner (f.eks., den lymfocytt protein Di-1) er forankret i den ytre pakningsvedlegget av plasma membran ved GPI ankere lagt til i sin C-terminus i endoplasmic reticulum. (mer…)
Andre proteiner er forankret i indre pakningsvedlegget av plasma membran ved kovalent bundet lipider. Snarere enn å bli behandlet gjennom secretory vei, disse proteinene er syntetisert på gratis cytosolic ribosomes og deretter endret ved tillegg av lipider., Disse endringene omfatter tillegg av myristic syre (en 14-karbon-fettsyre) til amino terminus av polypeptid-kjeden, tillegg av palmitinsyre (16 karbonatomer) til sidekjeder av cystein rester, og i tillegg prenyl grupper (15 eller 20 karbonatomer) til sidekjeder av carboxy-terminal cystein rester (se figur 7.29, 7.30, og 7.31). I noen tilfeller, disse proteinene (mange av dem oppfører seg som perifere membranproteiner) er rettet til plasma membran av positivt ladet regioner av polypeptid-kjeden, så vel som av den vedlagte lipider., Disse positivt ladet protein-domener kan samhandle med negativt ladet hodet grupper av phosphatidylserine på cytosolic ansiktet av plasma membran. Det er verdt å merke seg at mange av de proteiner som er forankret i indre pakningsvedlegget av plasma membran (inkludert Src og Ras proteiner illustrert i Figur 12.10) spiller en viktig rolle i overføring av signaler fra celleoverflaten intracellulære reseptorer mål, som diskutert i neste kapittel.