En titrering er en volumetrisk teknikk der en løsning av en reaktant (den titrant) er lagt til en løsning av et sekund reaktant (den «analytt») til ekvivalens punktet er nådd. Den ekvivalens punktet er det punktet som titrant har blitt lagt i akkurat rett mengde til å reagere stoichiometrically med analyten (når føflekker av titrant = føflekker av analytten). Hvis enten titrant eller analytten er farget, de ekvivalens poenget er tydelig fra forsvinningen av farge som reaktantene er fortært., Ellers, en indikator kan bli lagt til som har en «endepunkt» (skifter farge) ved ekvivalens punkt, eller ekvivalens punkt kan bestemmes fra en titrering kurve. Mengden av tilsatt titrant er bestemt ut fra sin konsentrasjon og volum:
n (mol) = C (mol/L) * V (L)
og mengden av titrant kan brukes på vanlig stoichiometric beregning for å bestemme mengden av analytten.
titrering prosessen kan sees i videoen nedenfor.,
En målt volum av løsningen for å være titrated, i dette tilfellet, fargeløs oppløsning i eddiksyre, CH3COOH(aq) er plassert i et beger. Den fargeløs sodium hydroxide NaOH(aq), som er den titrant, er lagt nøye ved hjelp av en buret. Volumet av titrant lagt kan da bestemmes ved å lese nivå av væske i buret før og etter titrering. Dette lesing kan vanligvis estimeres til nærmeste hundredels milliliter, så presis tillegg av titrant kan gjøres raskt.,
Som den første noen milliliter titrant strømme inn i kolben, noen indikator kort endringer i rosa, men kommer tilbake til fargeløs raskt. Dette er på grunn av et stort overskudd av eddiksyre. Den begrensende reagens NaOH er helt tømt.
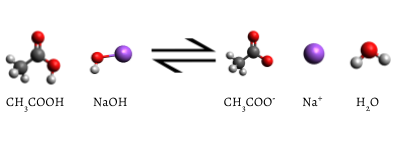
Det er lagt til indikatoren endres til i rosa når titrering er fullført, noe som indikerer at alle vandig eddiksyre har blitt fortært av NaOH(aq). Reaksjonen som oppstår er
\
til Slutt, alle eddiksyre er fortært., Tillegg på selv en brøkdel av en dråpe titrant produserer en varig rosa farge på grunn av ureagert NaOH i kolben. Fargen endring som oppstår ved endepunktet av indikator signaler som alle eddiksyre har blitt konsumert, så vi har nådd ekvivalens poenget med titrering. Hvis litt mer NaOH-løsning ble lagt til, vil det være et overskudd og fargen på løsningen i kolben ville få mye mørkere. Endepunktet vises plutselig, og forsiktighet må tas ikke til å gå over endepunktet.
Etter titrering har nådd endepunktet, et endelig volum leses fra buret., Ved hjelp av den første og siste lesing, volumet lagt kan bestemmes helt nøyaktig:
objektet i en titrering er alltid å legge til bare mengden av titrant nødvendig for å forbruke nøyaktig den mengde stoff som titrated. I NaOH—CH3COOH reaksjon Eq. \(\ref{2}\), den ekvivalens punkt oppstår når et lik molar mengde NaOH har blitt lagt fra uteksaminert sylinder for hver mole av CH3COOH opprinnelig i titrering kolbe., Det er, ved ekvivalens punkt forholdet mellom mengde NaOH, lagt til mengden av CH3COOH forbrukes må være lik stoichiometric ratio
\
Titrering er ofte brukt til å bestemme konsentrasjonen av en løsning. I mange tilfeller er det ikke en enkel sak å få tak i et rent stoff, veie det nøyaktig, og oppløse den i en volumetrisk kolbe som ble gjort i Eksempel 1 av Løsningen Konsentrasjoner. NaOH, for eksempel, kombinerer raskt med H2O og CO2 fra lufta, og så enda en nylaget eksempel av fast NaOH vil ikke bli ren., Vekten vil kontinuerlig forandring som CO2(g) og H2O(g) ble absorbert. Hydrogenklorid (HCl) er en gass ved vanlige temperaturer og høyt trykk, noe som gjør det svært vanskelig å håndtere eller veier. Vandige løsninger av begge disse stoffene må være standardisert; det er deres konsentrasjoner må bestemmes ved titrering.
den desidert mest vanlige bruken av titrations er med å bestemme ukjente, som er, i å bestemme konsentrasjonen eller mengden av stoffet i en prøve som vi i utgangspunktet visste ingenting. Neste eksempel innebærer en ukjent at mange mennesker opplever hver dag.,
308.0 mg som er innhentet i dette eksemplet er i rimelig nærhet til avtalen med produsentens krav på 300 mg. Tablettene er stemplet ut av maskiner, ikke veide individuelt, og så litt variasjon er forventet.