US Pharm. 2020;45(9):27-29.
ABSTRACT: Poiché gli ormoni sintetici sono stati combinati per la prima volta negli 1940, la terapia ormonale sostitutiva è stata ampiamente utilizzata dalle donne che hanno sintomi menopausali indesiderati. La ricerca successiva ha portato alla scoperta di diversi effetti negativi associati all’uso della terapia ormonale, scatenando discussioni sui rischi rispetto ai benefici del trattamento ormonale., A causa dei rischi connessi con le preparazioni commerciali, la terapia ormonale composta (CHT) è diventato più prominente, poichè è stata propagandata come alternativa biologicamente equivalente agli ormoni sintetici. Tuttavia, a causa del minimo a nessuna supervisione della FDA nel regno di compounding in generale, CHT potrebbe non essere sicuro come è stato pubblicizzato. Nel 2018, sulla base di risultati di prova favorevoli, Bijuva è diventato il primo approvato dalla FDA bioidentical combinazione 17-beta estradiolo-progesterone formulazione.,
Per decenni, le donne si sono rivolte alla terapia ormonale sostitutiva per trattare i sintomi vasomotori avversi associati alla menopausa, come vampate di calore e sudorazione notturna. Le donne possono trascorrere fino a un terzo della loro vita in uno stato di carenza ormonale, che contribuisce ulteriormente a tali effetti indesiderati come cambiamenti di umore, aumento del rischio di osteoporosi e diminuzione della libido. L’estrogeno sistemico è il trattamento più efficace per i sintomi vasomotori, mentre i sintomi genitourinari associati alla menopausa devono essere trattati con estrogeni topici a basse dosi.,1 Lo studio osservazionale sulla salute delle donne in tutta la nazione ha rilevato che le donne sperimentano sintomi vasomotori per una media di 7,4 anni dopo la menopausa.2 Tuttavia, la maggior parte dei medici consiglia che il trattamento dura per non più di 5 anni dopo la menopausa e consiglia vivamente di evitare la terapia ormonale del tutto nelle donne di età superiore ai 60 anni.1 Il medico deve valutare attentamente i rischi e i benefici associati agli ormoni sintetici e composti, tenendo presente l’obiettivo primario di migliorare la qualità della vita del paziente.,
Ormoni bioidentici
Gli ormoni bioidentici, come estrogeni, progestinici e androgeni, sono composti preparati secondo il capitolo USP <795> Standard di composizione non sterili. Questi ormoni possono essere composti in una varietà di dosaggi e forme di dosaggio, creando molte opzioni per le donne interessate alla terapia ormonale combinata (CHT)., Le formulazioni composte non subiscono la prova rigorosa delle norme di purezza e di fabbricazione che le loro controparti FDA-approvate fanno; tuttavia, nonostante questo ambiente non regolamentato, CHT è ampiamente popolare con i pazienti che cercano la medicina più “personalizzata”.
La Endocrine Society ha definito gli ormoni bioidentici composti come “composti che hanno la stessa identica struttura chimica e molecolare degli ormoni prodotti nel corpo umano.,”3 La FDA afferma che il termine ormone bioidentico è puramente una strategia di marketing, in quanto non vi è alcuna base scientifica per una riduzione implicita del beneficio o del rischio per la CHT rispetto alla terapia ormonale sintetica approvata dalla FDA.3
Terapia ormonale sintetica
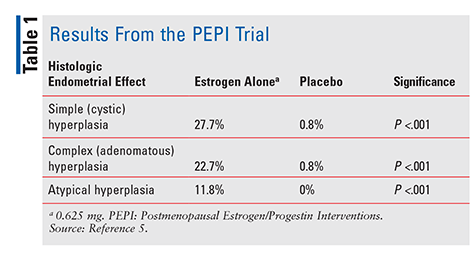
La FDA ha approvato il dietilstilbestrolo nel 1941 e gli estrogeni equini coniugati (CEE) nel 1942 per trattare i sintomi della menopausa.4 A partire dal 1960, le vendite di estrogeni salito alle stelle fino al 1975, quando i rapporti emerso che l’uso di estrogeni potrebbe essere associato ad un aumentato rischio di cancro endometriale.,4 Tuttavia, questi rapporti sono stati in gran parte ignorati e l’uso di estrogeni è continuato. Non fino al 1996, quando è stato pubblicato lo studio postmenopausale estrogeno/progestinico (PEPI), gli operatori sanitari hanno iniziato a comprendere veramente i potenziali effetti negativi associati alla terapia estrogenica. PEPI è stato uno studio multicentrico randomizzato di 3 anni, controllato con placebo, in doppio cieco, che ha esaminato gli effetti istologici dell’endometrio della terapia con estrogeni sintetici non opposti rispetto a tre diversi regimi di estrogeni sintetici più progestinici.,5
Nello studio PEPI, significativamente più soggetti trattati con estrogeni da soli hanno sviluppato iperplasia endometriale semplice, complessa o atipica rispetto ai soggetti trattati con placebo (TABELLA 1). Inoltre, mentre le percentuali esatte non sono state specificate, i tassi di iperplasia nei soggetti trattati con uno dei tre regimi estrogeno-più-progestinici erano simili a quelli nei soggetti trattati con placebo.5 In sintesi, la somministrazione di estrogeni da solo ad un dosaggio di 0.,625 mg al giorno hanno portato ad un aumento significativo dell’incidenza di iperplasia endometriale, mentre la combinazione di CEE con progestinico ha protetto l’endometrio dalla crescita eccessiva in misura considerevole.5 A causa di questo comprovato rischio di cancro endometriale, la progestina viene sempre somministrata in combinazione con estrogeni nelle donne con un utero intatto. A ulteriore conferma di questo rischio, una serie di casi del 2007 ha descritto tre donne che hanno usato CHT contenente dosi subterapeutiche di progestinico e in seguito hanno sviluppato il cancro endometriale.,6
Il PEPI prova, insieme con i risultati 16,068 donne in postmenopausa del Women’s Health Initiative (WHI), pubblicato nel 2002, di far luce sulle gravi preoccupazioni sollevate nel 1970.7 anche se il PEPI prova ha mostrato alcun aumento del rischio di iperplasia con il prodotto di combinazione, il WHI trovato significativamente aumentati i rischi associati con l’ormone sintetico utilizzare, come le malattie cardiovascolari, ictus, eventi tromboembolici, e il cancro al seno.,7 C’è stato un rischio aumentato di 80% di malattia cardiovascolare a 1 anno dopo la sospensione della terapia di associazione CEE/medrossiprogesterone acetato e un rischio aumentato di 37% di ictus ischemico durante la fase di intervento con la terapia di combinazione. Inoltre, il rischio di cancro al seno è stato significativamente aumentato (24%) durante l’intervento. L’uso di estrogeno-più-progestinico ha fornito alcuni benefici, con i pazienti che notano una diminuzione dell’incidenza di atrofia vaginale, sintomi vasomotori ridotti come vampate di calore e sudorazioni notturne e un rischio ridotto del 38% di cancro del colon-retto durante il trattamento con la terapia di combinazione.,7 Nondimeno, a causa dell’importanza dell’aumentato rischio di cancro al seno e di eventi tromboembolici, lo studio è stato interrotto precocemente.
Terapia ormonale combinata
I rischi discussi sopra hanno aperto la strada alla difesa del CHT perché si pensava che personalizzare o personalizzare il CHT al singolo paziente massimizzasse il beneficio e minimizzasse il rischio. Sostiene che CHT era più sicuro e biologicamente più amichevole è diventato più prominente, e il suo uso è aumentato., Pinkerton e Santoro hanno utilizzato due diversi sondaggi—Harris e Rose—per valutare la conoscenza del CHT dei pazienti e quantificare l’uso di CHT rispetto alla terapia ormonale approvata dalla FDA, rispettivamente.8 I risultati del sondaggio Harris hanno indicato che l ‘ 86% delle donne di età compresa tra 40 e 65 anni non erano a conoscenza del fatto che la CHT non fosse approvata dalla FDA e i risultati estrapolati del sondaggio Rose hanno suggerito che, ogni anno, fino a 2,5 milioni di donne di età superiore ai 40 anni possono utilizzare la CHT.8 I dati di entrambe le indagini hanno indicato che un medico o un farmacista aveva raccomandato CHT., Questi risultati suggeriscono che esiste un’opportunità per i fornitori di garantire che i pazienti siano informati sul prodotto che stanno ricevendo, compresi tutti i possibili rischi associati alla terapia ormonale, e per i farmacisti di compounding per garantire che stiano fornendo un prodotto terapeuticamente puro di cui i pazienti possono fidarsi.
Poiché la FDA non è responsabile della standardizzazione dei prodotti composti, la regolamentazione spesso ricade sui consigli di stato della farmacia., Queste schede in genere non hanno le risorse per condurre ispezioni regolari delle farmacie compounding, e la FDA interviene solo quando viene presentata una denuncia.9 Sebbene le formulazioni composte non siano legalmente tenute a portare avvertenze sui rischi, teoricamente questi prodotti possono comportare gli stessi rischi di quelli sopra menzionati per la terapia ormonale sintetica. Ad oggi, tuttavia, non ci sono stati test di sicurezza testa a testa di CHT rispetto agli ormoni sintetici.,10
Esistono tre tipi di estrogeni che una donna può ricevere come parte di un regime ormonale sostitutivo composto: estrone (E1), estradiolo (E2) ed estriolo (E3), ciascuno con un grado di potenza variabile (E2> E1> E3).9 Poiché si contendono lo stesso recettore, questi estrogeni agiscono come inibitori competitivi, con conseguente diminuzione dell’efficacia se non correttamente bilanciata.,11 Di conseguenza, i sostenitori di CHT hanno sviluppato Biest (E2 + E3 in una formulazione 20/80) e Triest (E1 + E2 + E3 in una formulazione 10/10/80) al fine di massimizzare la potenza fisiologica, ma non vi è attualmente alcuna prova a sostegno dell’affermazione che queste formulazioni in questi rapporti conferiscono alcun beneficio di sicurezza rispetto alla terapia ormonale sintetica.11
Sebbene nel complesso la CHT sia stata studiata in modo inadeguato e non regolamentata, nell’ottobre 2018, sulla base dei risultati dello studio REPLENISH, Bijuva è diventata la prima formulazione bioidentical 17-beta estradiol-progesterone approvata dalla FDA., REPLENISH, uno studio multicentrico di fase III, randomizzato, in doppio cieco, controllato con placebo, ha studiato l’efficacia, la sicurezza endometriale e la sicurezza complessiva di quattro diversi dosaggi di una singola capsula di estradiolo-progesterone 17-beta per i sintomi vasomotori da moderati a gravi nelle donne in postmenopausa.12 L ‘endpoint primario di sicurezza era l’ incidenza di iperplasia endometriale a 12 mesi. A 12 mesi, non sono stati osservati casi di iperplasia endometriale per nessuna delle formulazioni di dosaggio di estradiolo-progesterone.,12 A 12 settimane, la formulazione di estradiolo 1 mg–progesterone 100 mg ha dimostrato la più grande riduzione statisticamente significativa della frequenza e della gravità dei sintomi vasomotori rispetto al placebo, mantenendo gli standard primari di endpoint di sicurezza.12 Tuttavia, come accennato in precedenza, non ci sono stati studi che confrontano la sicurezza degli ormoni sintetici rispetto alle formulazioni ormonali bioidentiche, quindi teoricamente i rischi rimangono.,
Conclusione
Sulla base dello studio REPLENISH, le donne pre-, peri-e postmenopausali hanno ora un trattamento standardizzato, regolamentato, bioidentico, approvato dalla FDA per i sintomi vasomotori. Sono necessari studi futuri per delineare completamente il profilo di sicurezza di 17-beta estradiolo e CHT. I farmacisti dovrebbero raccomandare qualsiasi formulazione ormonale orale per la durata più breve possibile., Inoltre, se viene scelto il CHT, i farmacisti dovrebbero assicurarsi che i loro pazienti sappiano cos’è il CHT e come si differenzia dagli ormoni sintetici mentre hanno anche una conversazione franca sui benefici e sui rischi della terapia ormonale sostitutiva.
1. Martin KA, Manson JE. Approccio al paziente con sintomi della menopausa. J Clin Endocrinol Metab. 2008;93(12):4567-4575.
2. I nostri servizi sono a vostra disposizione. Durata dei sintomi vasomotori della menopausa durante la transizione della menopausa. JAMA Stagista Med. 2015;175(4):531-539.
3. Santoro N, Braunstein GD, Butts CL, et al., Ormoni bioidentici composti nella pratica dell’endocrinologia: una dichiarazione scientifica della società endocrina. J Clin Endocrinol Metab. 2016;101(4):1318-1343.
4. Stefanick ML. Estrogeni e progestinici: background e storia, tendenze in uso e linee guida e regimi approvati dalla Food and Drug Administration degli Stati Uniti. Sono J Med. 2005;118 (suppl 12B): 64-73.
5. Gruppo di scrittura per il processo PEPI. Effetti della terapia ormonale sostitutiva sull’istologia endometriale nelle donne in postmenopausa. La prova postmenopausale di interventi progestinici/dell’estrogeno (PEPI). JAMA. 1996;275(5):370-375.
6., Eden JA, Hacker NF, Fortune M. Tre casi di cancro endometriale associati alla terapia ormonale sostitutiva “bioidentica”. Med J Aust. 2007;187(4):244-245.
7. I nostri servizi sono a vostra disposizione. Rischi e benefici di estrogen plus progestin in donne sane in postmenopausa: principali risultati dello studio controllato randomizzato Women’s Health Initiative. JAMA. 2002;288(3):321-333.
8. Pinkerton JV, Santoro N. Terapia ormonale bioidentica composta: identificazione delle tendenze d’uso e delle lacune di conoscenza tra le donne statunitensi. Menopausa. 2015;22(9):926-936.
9. Bhavnani BR, Stanczyk FZ., Equivoco e preoccupazioni sugli ormoni bioidentici utilizzati per la terapia ormonale personalizzata. J Clin Endocrinol Metab. 2012;97(3):756-759.
10. Bijuva (estradiolo e progesterone) foglietto illustrativo. Boca Raton, FL: TherapeuticsMD, Inc; Novembre 2019.
11. Kuhl H. Farmacologia di estrogeni e progestinici: influenza delle diverse vie di somministrazione. Climaterico. 2005; 8 (suppl 1): 3-63.
12. Lobo RA, Archer DF, Kagan R, et al. Una capsula orale 17beta-estradiolo-progesterone per i sintomi vasomotori nelle donne in postmenopausa: uno studio controllato randomizzato. Obstet Gynecol., 2018;132(1):161-170.
Il contenuto contenuto in questo articolo è solo a scopo informativo. Il contenuto non è inteso come un sostituto per la consulenza professionale. L’affidamento su qualsiasi informazione fornita in questo articolo è esclusivamente a proprio rischio.