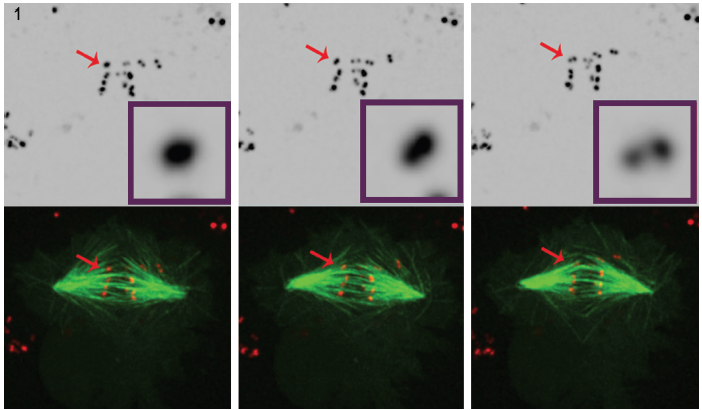
Figura 1. Tre immagini fisse selezionate da un filmato di cellule impoverite di POLO mostrano chiaramente che, nel tempo, il segnale intenso centromero / cinetocore (rosso) si risolve in una coppia di punti, il che dimostra che i cromosomi sono sintelicamente attaccati ai microtubuli del mandrino (verde). I set di dati di microscopia a fluorescenza 4D sono stati raccolti ogni 30 secondi con 0.,z-step da 5 mm che coprono l’intero volume della cella utilizzando un obiettivo plan-apocromatico a 100°, 1,4 NA a 25 ° C con l’unità confocale Revolution spinning disk di Andor e la fotocamera iXon EMCCD, entrambi guidati dal software Andor IQ live-cell imaging.
La divisione cellulare mitotica si basa sulla capacità delle cellule di distribuire correttamente i cromatidi fratelli in cellule formanti. Per eseguire in modo affidabile la funzione, le cellule utilizzano meccanismi di modifica interni per correggere gli allegati imprecisi di fibre cromosomiche / mandrino., I cinetocori accoppiati sono solitamente allineati per attaccare correttamente le fibre del fuso e separare la cromatina, tuttavia, i cinetocori errati e disallineati risultano. Le celle contengono meccanismi di editing specializzati per prevenire e correggere queste coppie di kinetocore disallineate, sebbene il meccanismo esatto non sia ben compreso 1,2 ., È postulato da Tatiana Moutinho-Santos presso l’Universidade do Porto, Instituto de Biologia Molecolare e Celular (IBMC) del Portogallo che la presenza di POLO chinasi è necessaria per promuovere il bi-orientamento cromosomico (definito disposizione anfitelica) e quindi preservare il corretto allineamento del cinetocoro.
Per comprendere meglio il suo ruolo nella regolazione dello sviluppo del cinetocoro, il Dr. Moutinho dos Santos ha studiato la Drosophila POLO chinasi impoverita all’interno delle cellule vive per dimostrare il coinvolgimento di POLO nelle funzioni di editing necessarie per mantenere la disposizione del cinetocoro anfitelico., In questo caso, è stata studiata la disposizione sintelica (kinetocori gemelli attaccati ai microtubuli provenienti dallo stesso fuso). L’analisi timelapse della mitosi è stata eseguita su cellule di Drosophila S2 che esprimono stabilmente CID-mCherry per la visualizzazione dei centromeri e GFP-a-tubulina per i microtubuli. La visualizzazione dei cinetocori è impegnativa a causa delle loro piccole dimensioni, del basso segnale fluorescente e del breve aspetto durante la divisione cellulare. La microscopia confocale di fluorescenza è usata spesso ai cinetocori di immagine, tuttavia, anche in questo ambiente, la visualizzazione rimane difficile., I cinetocori sono molto piccoli (300 nm)3, vicini alle capacità di risoluzione laterale del microscopio ottico e superano la capacità di risoluzione assiale del microscopio. Inoltre, l’imaging dei marcatori fluorescenti all’interno delle cellule viventi pone potenziali effetti fototossici e fotobleaching. L’illuminazione laser intensa può creare problemi di fototossicità, particolarmente dannosi per le cellule viventi e divisorie.
La microscopia confocale a disco rotante Revolution XD di Andor è impiegata per superare la sfida unica del Dr. Moutinho dos Santo associata all’osservazione dei cinetocori., In questo caso, quattro diversi fattori devono essere contemporaneamente affrontato adeguatamente visualizzare la dinamica di processi cellulari:
- Velocità di acquisizione
- Spaziale e temporale risoluzione di capacità
- La possibilità di individuare molto bassi di intensità di fluorescenza livelli
- Gestione e disponibili segnale di fluorescenza
Questi temi spaziali, temporale e l’intensità risoluzione si verifica frequentemente con microscopia di fluorescenza e sono spesso in contrasto con gli esperimenti che coinvolgono l’osservazione della vitalità cellulare., Ad esempio, lunghe esposizioni fotografiche e lunghi periodi di illuminazione ad alta intensità generano gli effetti fototossici che danneggiano o distruggono le cellule viventi. Contemporaneamente, le microstrutture leggermente etichettate richiedono un’esposizione più lunga per visualizzare ma possono essere influenzate negativamente dal photobleaching. Ad aggravare il problema è la necessità di combinare i dati tridimensionali tradizionali con quello del tempo. Infine, rimane necessario discernere il segnale dal rumore di fondo e dalla foschia fuori fuoco.
La velocità di acquisizione è di particolare importanza per il Dr. Mountinho dos Santos., Le celle di controllo S2 presentano un ciclo di divisione di circa 30 minuti. Tuttavia, le cellule S2 esaurite di POLO utilizzate nei suoi esperimenti hanno mostrato un periodo di arresto superiore a otto ore. La registrazione della divisione cellulare esaurita POLO richiede la raccolta di tra 7.200 e 12.000 set di immagini (due fluorocromi imaged ogni trenta secondi per una a cinque ore, acquisiti a 0,5 micron passi assiali fino a 20 passi per la risoluzione cinetocore assiale)., La microscopia a fluorescenza convenzionale e l’illuminazione laser non consentiranno né i requisiti di illuminazione delicati necessari né la velocità di acquisizione per completare questo compito sensibile al tempo. Ad esempio, la rasterizzazione laser nella microscopia confocale tradizionale richiede periodi di tempo più lunghi per raccogliere il segnale dal campione. I sistemi confocali a disco rotante vengono utilizzati per superare queste barriere tradizionali e per rivelare nuove intuizioni sulle tecniche di editing del cinetocoro molecolare.,
Rispetto ai sistemi convenzionali a fluorescenza a campo largo, la risoluzione spaziale di un disco rotante confocale è superiore sia nelle dimensioni laterali (x e y) che assiali (z). Attraverso la scansione costante dell’array pinhole, i campioni possono essere visualizzati in tempo reale ad alto contrasto, fornendo immagini chiare ai limiti di diffrazione dell’ottica del microscopio. Ciò consente la visualizzazione 3D e la comprensione del comportamento dinamico del cinetocore in relazione ai microtubuli del mandrino., Kinetochore e centromero risoluzione laterale di 300nm e risoluzione fibra mandrino di 300-500 nm sono stati riportati e sono dettagliati in Figura A.
Risoluzione intensità
Visualizzazione dei kinetocori fluorescenti etichettati associati a ciascun centromero pone ulteriori esigenze sul sistema di acquisizione. I centromeri e i cinetocori in studio sono visibili principalmente solo durante l’interfase della divisione cellulare. Mentre le cellule passano attraverso la profase, i centromeri si sono già risolti nelle tipiche coppie cromosomiche di Drosophila., La gestione del budget di luce disponibile durante la lunga acquisizione richiede un’illuminazione delicata e un’alta risoluzione in grado di ruotare le tecniche del disco. Le aperture all’interno dell’unità di filatura del disco forniscono questi benefici. Poiché la luce eccita i fluorofori solo quando è presente un’apertura, gli effetti fototossici sono ridotti al minimo. Mentre controintuitivo, un budget luce ridotta non indica debole, oggetti difficili da rilevare. La risoluzione dell’intensità viene aumentata attraverso l’esclusione del segnale fuori fuoco da parte del disco rotante e la successiva amplificazione del segnale da parte di un’architettura della fotocamera EMCCD., Ciò crea la nuova possibilità di generare immagini a contrasto più elevato che rivelano lo sviluppo e l’allineamento di oggetti punteggiati come i cinetocori.
Conclusioni
L’uso della tecnologia del disco rotante nell’applicazione live cell del Dr. Mountinho dos Santos ha portato a un’osservazione importante. In assenza della POLO chinasi, è stato dimostrato che le cellule di Drosophila mancano dei meccanismi correttivi necessari per mantenere la disposizione dei cromosomi anfitelici., La presenza di POLO ha dimostrato di fornire l’ambiente giusto per una corretta architettura centromerica, garantendo contemporaneamente il corretto bi-orientamento cromosomico. Le cellule di Drosophila coltivate sottoposte a mitosi in assenza di cromosomi POLO chinasi si attaccano alle fibre del fuso con orientamento sintelico, cioè con cinetocori gemelli attaccati ai microtubuli che provengono da un singolo polo del fuso.
Questa conclusione è stata tratta da un’attenta analisi della microscopia a fluorescenza 4D in cellule che esprimono marcatore centromero / cinetocoro fluorescenti e microtubuli. (Figura 1).