Proteine di membrana
Mentre i lipidi sono gli elementi strutturali fondamentali delle membrane, le proteine sono responsabili dello svolgimento di specifiche funzioni di membrana. La maggior parte delle membrane plasmatiche sono costituite da circa il 50% di lipidi e il 50% di proteine in peso, con le porzioni di carboidrati di glicolipidi e glicoproteine che costituiscono il 5-10% della massa della membrana. Poiché le proteine sono molto più grandi dei lipidi, questa percentuale corrisponde a circa una molecola proteica ogni 50-100 molecole di lipidi., Nel 1972, Jonathan Singer e Garth Nicolson proposero il modello a mosaico fluido della struttura della membrana, che ora è generalmente accettato come paradigma di base per l’organizzazione di tutte le membrane biologiche. In questo modello, le membrane sono viste come fluidi bidimensionali in cui le proteine vengono inserite in doppi strati lipidici (Figura 12.3).

Figura 12.3
Modello a mosaico fluido della membrana plasmatica., Le proteine integrali della membrana sono inserite nel doppio strato lipidico, mentre le proteine periferiche sono legate alla membrana indirettamente dalle interazioni proteina-proteina. La maggior parte delle proteine di membrana integrali sono transmembrana (altro…)
Singer e Nicolson hanno distinto due classi di proteine associate alla membrana, che hanno chiamato proteine di membrana periferiche e integrali., Le proteine di membrana periferiche sono state definite operativamente come proteine che si dissociano dalla membrana in seguito a trattamenti con reagenti polari, come soluzioni di pH estremo o alta concentrazione di sale, che non interrompono il doppio strato di fosfolipidi. Una volta dissociate dalla membrana, le proteine della membrana periferica sono solubili in tamponi acquosi. Queste proteine non sono inserite nell’interno idrofobo del doppio strato lipidico. Invece, sono indirettamente associati alle membrane attraverso interazioni proteina-proteina., Queste interazioni coinvolgono frequentemente legami ionici, che sono interrotti da pH estremo o sale elevato.
In contrasto con le proteine di membrana periferiche, le proteine di membrana integrali possono essere rilasciate solo da trattamenti che interrompono il doppio strato fosfolipidico. Porzioni di queste proteine di membrana integrali sono inserite nel doppio strato lipidico, quindi possono essere dissociate solo da reagenti che interrompono le interazioni idrofobiche., I reagenti più comunemente usati per la solubilizzazione delle proteine di membrana integrali sono i detergenti, che sono piccole molecole anfipatiche contenenti sia gruppi idrofobici che idrofili (Figura 12.4). Le porzioni idrofobiche dei detergenti spostano i lipidi di membrana e si legano alle porzioni idrofobiche delle proteine integrali di membrana. Poiché l’altra estremità della molecola detergente è idrofila, i complessi di proteine detergenti sono solubili in soluzioni acquose.

Figura 12.4
Solubilizzazione di proteine integrali di membrana mediante detergenti., I detergenti (ad esempio, octyl glucoside) sono molecole anfipatiche contenenti gruppi di testa idrofili e code idrofobiche. Le code idrofobiche legano alle regioni idrofobiche della membrana integrale (più…)
Molte proteine integrali sono proteine transmembrana, che coprono il doppio strato lipidico con porzioni esposte su entrambi i lati della membrana. Queste proteine possono essere visualizzate in micrografie elettroniche di membrane plasmatiche preparate con la tecnica della frattura da congelamento (vedi Figura 1.35). In questi esemplari, la membrana è divisa e si separa nei suoi due foglietti., Le proteine transmembrane sono quindi evidenti come particelle sulle facce interne della membrana (Figura 12.5).

Figura 12.5
Micrografo elettronico a frattura da congelamento delle membrane dei globuli rossi umani. Le particelle nella membrana sono proteine transmembrana. (Harold H. Edwards / Visuals Unlimited.,)
Le porzioni di membrana delle proteine transmembrana sono solitamente α eliche di 20-25 amminoacidi idrofobi che vengono inseriti nella membrana del reticolo endoplasmatico durante la sintesi della catena polipeptidica (vedere Figure 9.11, 9.12 e 9.13). Queste proteine vengono quindi trasportate in vescicole di membrana dal reticolo endoplasmatico all’apparato di Golgi e da lì alla membrana plasmatica., I gruppi di carboidrati vengono aggiunti alle catene polipeptidiche sia nel reticolo endoplasmatico che nell’apparato di Golgi, quindi la maggior parte delle proteine transmembrana della membrana plasmatica sono glicoproteine con i loro oligosaccaridi esposti sulla superficie della cellula.
Gli studi sui globuli rossi hanno fornito buoni esempi di proteine sia periferiche che integrali associate alla membrana plasmatica. Le membrane degli eritrociti umani contengono circa una dozzina di proteine principali, che sono state originariamente identificate mediante elettroforesi su gel di preparati a membrana., La maggior parte di queste sono proteine di membrana periferiche che sono state identificate come componenti del citoscheletro corticale, che è alla base della membrana plasmatica e determina la forma delle cellule (vedere Capitolo 11). Ad esempio, la proteina di membrana periferica più abbondante dei globuli rossi è la spettrina, che è la principale proteina citoscheletrica degli eritrociti. Altre proteine di membrana periferiche dei globuli rossi includono actina, anchirina e banda 4.1., L’anchirina funge da collegamento principale tra la membrana plasmatica e il citoscheletro legandosi sia alla spettrina che alla banda proteica integrale di membrana 3 (vedere Figura 11.11). Un ulteriore collegamento tra la membrana e il citoscheletro è fornito dalla banda 4.1, che si lega alle giunzioni di spettrina e actina, nonché alla glicoforina (l’altra importante proteina di membrana integrale degli eritrociti).
Le due principali proteine integrali di membrana dei globuli rossi, la glicoforina e la banda 3, forniscono esempi ben studiati di struttura proteica transmembrana (Figura 12.6)., La glicoforina è una piccola glicoproteina di 131 aminoacidi, con un peso molecolare di circa 30.000, metà dei quali è proteina e metà carboidrati. La glicoforina attraversa la membrana con una singola elica α di membrana di 23 aminoacidi, con la sua porzione amino-terminale glicosilata esposta sulla superficie cellulare. Sebbene la glicoforina sia stata una delle prime proteine transmembrana ad essere caratterizzata, la sua precisa funzione rimane sconosciuta. Al contrario, la funzione dell’altra proteina transmembrana principale dei globuli rossi è ben compresa., Questa proteina, originariamente nota come banda 3, è il trasportatore anionico responsabile del passaggio di ioni bicarbonato (HCO3-) e cloruro (Cl-) attraverso la membrana dei globuli rossi. La catena del polipeptide della banda 3 è 929 aminoacidi ed è pensata per avere 14 regioni α-elicoidali membrana-spanning. All’interno della membrana, i dimeri della banda 3 formano strutture globulari contenenti canali interni attraverso i quali gli ioni sono in grado di viaggiare attraverso il doppio strato lipidico.
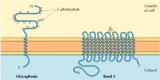
Figura 12.6
Proteine integrali di membrana dei globuli rossi., La glicoforina (131 aminoacidi) contiene una singola elica α transmembrana. È fortemente gliocosilato, con oligosaccaridi attaccati a 16 siti sulla porzione extracellulare della catena polipeptidica. (piu…)
A causa del loro carattere anfipatico, le proteine transmembrana si sono dimostrate difficili da cristallizzare, come richiesto per l’analisi strutturale tridimensionale mediante diffrazione a raggi X., La prima proteina transmembrana ad essere analizzata mediante cristallografia a raggi X è stato il centro di reazione fotosintetica del batterio Rhodopseudomonas viridis, la cui struttura è stata riportata nel 1985 (Figura 12.7). Il centro di reazione contiene tre proteine transmembrana, designate L, M e H (leggere, medie e pesanti) in base alle loro dimensioni apparenti indicate dall’elettroforesi su gel. Le subunità L e M hanno ciascuna cinque eliche α a membrana. La subunità H ha solo una singola elica α transmembrana, con la maggior parte della catena polipeptidica sul lato citosolico della membrana., La quarta subunità del centro di reazione è un citocromo, che è una proteina di membrana periferica legata al complesso dalle interazioni proteina-proteina.

Figura 12.7
Un centro di reazione fotosintetica batterica. Il centro di reazione è costituito da tre proteine transmembrana, designate L (rosso), M (giallo) e H (verde). Le subunità L e M hanno ciascuna cinque eliche α transmembrana, mentre la subunità H ha solo (altro…)
Sebbene la maggior parte delle proteine transmembrana copra la membrana per regioni α-elicoidali, questo non è sempre il caso., Un’eccezione ben caratterizzata è fornita dalle porine-una classe di proteine che formano canali nelle membrane esterne di alcuni batteri. Molti batteri, tra cui E. coli, hanno un sistema a doppia membrana in cui la membrana plasmatica (o membrana interna) è circondata dalla parete cellulare e una membrana esterna distinta (Figura 12.8). In contrasto con la membrana plasmatica, la membrana esterna è altamente permeabile agli ioni e alle piccole molecole polari (nel caso di E. coli, con pesi molecolari fino a 600). Questa permeabilità deriva dalle porine, che formano canali acquosi aperti attraverso il doppio strato lipidico., Come discusso nel capitolo 10, le proteine relative alle porine batteriche si trovano anche nelle membrane esterne dei mitocondri e dei cloroplasti.
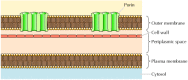
Figura 12.8
Membrane esterne batteriche. La membrana plasmatica di alcuni batteri è circondata da una parete cellulare e da una membrana esterna distinta. La membrana esterna contiene porine, che formano canali acquosi aperti che consentono il libero passaggio di ioni e piccole molecole.
L’analisi strutturale ha indicato che le porine non contengono regioni α-elicoidali idrofobiche., Invece, attraversano la membrana come barili β, in cui 16 fogli β si piegano in una struttura simile a un barile che racchiude un poro acquoso (Figura 12.9). Le catene laterali degli amminoacidi polari allineano il poro, mentre le catene laterali degli amminoacidi idrofobi interagiscono con l’interno della membrana. I monomeri porinici si associano per formare trimeri stabili, ognuno dei quali contiene tre canali aperti attraverso i quali le molecole polari possono diffondersi attraverso la membrana.

Figura 12.9
Struttura di un monomero porinico., Ogni monomero è un barile β costituito da 16 filamenti β antiparalleli (frecce). L’estremità superiore della molecola si affaccia sul mezzo esterno. (Da H. Nikaido, 1994. J. Biol. Chimica. 269: 3905.)
In contrasto con le proteine transmembrana, una varietà di proteine (molte delle quali si comportano come proteine di membrana integrali) sono ancorate nella membrana plasmatica da lipidi o glicolipidi covalentemente attaccati (Figura 12.10). I membri di una classe di queste proteine sono inseriti nel foglio esterno della membrana plasmatica da ancore di glicosilfosfatidilinositolo (GPI)., Gli ancoraggi GPI vengono aggiunti a determinate proteine che sono state trasferite nel reticolo endoplasmatico e sono ancorate nella membrana da una regione transmembrana C-terminale (vedere Figura 9.16). La regione transmembrana viene scissa quando viene aggiunta l’ancora GPI, quindi queste proteine rimangono attaccate alla membrana solo dal glicolipide. Poiché le catene polipeptidiche delle proteine ancorate al GPI vengono trasferite nel reticolo endoplasmatico, vengono glicosilate ed esposte sulla superficie della cellula dopo il trasporto alla membrana plasmatica.
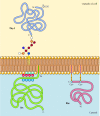
Figura 12.,10
Esempi di proteine ancorate nella membrana plasmatica da lipidi e glicolipidi. Alcune proteine (ad esempio, la proteina linfocitaria Thy-1) sono ancorate nel foglio esterno della membrana plasmatica da ancore GPI aggiunte al loro terminale C nel reticolo endoplasmatico. (piu…)
Altre proteine sono ancorate nel foglio interno della membrana plasmatica da lipidi covalentemente attaccati. Invece di essere elaborati attraverso la via secretoria, queste proteine sono sintetizzate su ribosomi citosolici liberi e quindi modificate mediante l’aggiunta di lipidi., Queste modifiche includono l’aggiunta di acido miristico (14-carbonio degli acidi grassi) per l’amino-terminale della catena polipeptidica, l’aggiunta di acido palmitico (16 atomi di carbonio) per le catene laterali dei residui di cisteina, e l’aggiunta di prenil gruppi (15 o 20 atomi di carbonio) per le catene laterali di carbossi-terminale di residui di cisteina (vedi figura 7.29, 7.30, e 7.31). In alcuni casi, queste proteine (molte delle quali si comportano come proteine di membrana periferiche) sono mirate alla membrana plasmatica da regioni caricate positivamente della catena polipeptidica e dai lipidi attaccati., Questi domini di proteine caricati positivamente possono interagire con i gruppi di testa caricati negativamente di fosfatidilserina sulla faccia citosolica della membrana plasmatica. È interessante notare che molte delle proteine ancorate nel foglio interno della membrana plasmatica (incluse le proteine Src e Ras illustrate nella Figura 12.10) svolgono un ruolo importante nella trasmissione di segnali dai recettori della superficie cellulare ai bersagli intracellulari, come discusso nel prossimo capitolo.