Obiettivi formativi
Alla fine di questa sezione, sarete in grado di:
- Descrivere come sono stati scoperti gli elettroni.
- Spiega l’esperimento Millikan oil drop.
- Descrivi l’esperimento della lamina d’oro di Rutherford.
- Descrivi il modello planetario dell’atomo di Rutherford.
Proprio come gli atomi sono una sottostruttura della materia, elettroni e nuclei sono sottostrutture dell’atomo., Gli esperimenti che sono stati usati per scoprire elettroni e nuclei rivelano alcune delle proprietà di base degli atomi e possono essere facilmente compresi usando idee come la forza elettrostatica e magnetica, già trattate nei capitoli precedenti.
Cariche e forze elettromagnetiche
Nelle discussioni precedenti, abbiamo notato che la carica positiva è associata ai nuclei e la carica negativa agli elettroni. Abbiamo anche coperto molti aspetti delle forze elettriche e magnetiche che influenzano le cariche., Ora esploreremo la scoperta dell’elettrone e del nucleo come sottostrutture dell’atomo ed esamineremo i loro contributi alle proprietà degli atomi.
L’elettrone

Figura 1. Un tubo di scarico del gas si illumina quando viene applicata un’alta tensione. Gli elettroni emessi dal catodo sono accelerati verso l’anodo; eccitano atomi e molecole nel gas, che brillano in risposta., Una volta chiamati tubi Geissler e successivamente tubi Crookes, ora sono noti come tubi a raggi catodici (CRT) e si trovano in vecchi televisori, schermi di computer e macchine a raggi X. Quando viene applicato un campo magnetico, il fascio si piega nella direzione prevista per la carica negativa. (credit: Paul Downey, Flickr)
I tubi di scarico del gas, come quello mostrato in Figura 1, sono costituiti da un tubo di vetro evacuato contenente due elettrodi metallici e un gas rarefatto. Quando viene applicata un’alta tensione agli elettrodi, il gas si illumina. Questi tubi sono stati i precursori delle luci al neon di oggi., In primo luogo sono stati studiati seriamente da Heinrich Geissler, un inventore tedesco e vetraio, a partire dal 1860. Lo scienziato inglese William Crookes, tra gli altri, ha continuato a studiare che per qualche tempo sono stati chiamati tubi di Crookes, in cui gli elettroni sono liberati da atomi e molecole nella rarefatta di gas all’interno del tubo e sono accelerati dal catodo (negativo) verso l’anodo (positivo) dall’elevato potenziale., Questi “raggi catodici” si scontrano con gli atomi e le molecole di gas e li eccitano, causando l’emissione di radiazioni elettromagnetiche (EM) che rendono visibile il percorso degli elettroni come un raggio che si diffonde e svanisce mentre si allontana dal catodo.
I tubi a scarica di gas oggi sono più comunemente chiamati tubi a raggi catodici, perché i raggi hanno origine nel catodo. Crookes ha dimostrato che gli elettroni trasportano quantità di moto (possono far ruotare una piccola ruota a pale)., Ha anche scoperto che il loro percorso normalmente rettilineo è piegato da un magnete nella direzione prevista per una carica negativa che si allontana dal catodo. Queste furono le prime indicazioni dirette degli elettroni e della loro carica.

Figura 2. J. J. Thomson (credito: www.firstworldwar.com, via Wikimedia Commons)
Il fisico inglese J. J. Thomson (1856-1940) ha migliorato e ampliato la portata degli esperimenti con tubi a scarica di gas. (Vedi Figura 2 e Figura 3.,) Ha verificato la carica negativa dei raggi catodici sia con campi magnetici che elettrici. Inoltre, ha raccolto i raggi in una tazza di metallo e ha trovato un eccesso di carica negativa. Thomson è stato anche in grado di misurare il rapporto tra la carica dell’elettrone e la sua massa, \frac{q_e}{m_e}\\—un passo importante per trovare i valori effettivi sia di qe che di me. La figura 4 mostra un tubo a raggi catodici, che produce un fascio stretto di elettroni che passa attraverso le piastre di ricarica collegate a un alimentatore ad alta tensione., Un campo elettrico E viene prodotto tra le piastre di ricarica e il tubo a raggi catodici viene posizionato tra i poli di un magnete in modo che il campo elettrico E sia perpendicolare al campo magnetico B del magnete. Questi campi, essendo perpendicolari tra loro, producono forze opposte sugli elettroni. Come discusso per gli spettrometri di massa in più applicazioni del magnetismo, se la forza netta dovuta ai campi scompare, allora la velocità della particella carica è v=\frac{E}{B}\\., In questo modo, Thomson determinato la velocità degli elettroni e poi spostato il fascio su e giù regolando il campo elettrico.

Figura 3. Schema del CRT di Thomson. (credito: Kurzon, Wikimedia Commons)

Figura 4. Questo schema mostra il fascio di elettroni in un CRT che passa attraverso campi elettrici e magnetici incrociati e fa brillare il fosforo quando colpisce l’estremità del tubo.
Termini di raccolta, abbiamo \frac{q_e}{m_e}=\frac{a}{E}\\.,
Cosa c’è di così importante in \frac{q_e}{m_e}\\, il rapporto tra la carica dell’elettrone e la sua massa? Il valore ottenuto è
\displaystyle\frac{q_e}{m_e}=-1.76\times10^{11}\text{ C/kg (electron)}\\
Questo è un numero enorme, come realizzato da Thomson, e implica che l’elettrone abbia una massa molto piccola. Era noto dalla galvanizzazione che circa 108 C/kg sono necessari per piastrare un materiale, un fattore di circa 1000 in meno rispetto alla carica per chilogrammo di elettroni., Thomson ha continuato a fare lo stesso esperimento per gli ioni idrogeno caricati positivamente (ora noti per essere protoni nudi) e ha trovato una carica per chilogrammo circa 1000 volte più piccola di quella per l’elettrone, il che implica che il protone è circa 1000 volte più massiccio dell’elettrone. Oggi, sappiamo più precisamente che
\displaystyle\frac{q_p}{m_p}=9.58\times10^{7}\text{ C/kg (proton)}\\,
dove qp è la carica del protone e mp è la sua massa. Questo rapporto (a quattro cifre significative) è 1836 volte meno carica per chilogrammo rispetto all’elettrone., Poiché le cariche di elettroni e protoni sono uguali in grandezza, ciò implica mp = 1836me.
Thomson eseguì una serie di esperimenti utilizzando diversi gas nei tubi di scarico e impiegando altri metodi, come l’effetto fotoelettrico, per liberare elettroni dagli atomi. Ha sempre trovato le stesse proprietà per l’elettrone, dimostrando di essere una particella indipendente. Per il suo lavoro, i cui pezzi importanti iniziarono a pubblicare nel 1897, Thomson ricevette il Premio Nobel per la fisica nel 1906., In retrospettiva, è difficile apprezzare quanto sia stato sorprendente scoprire che l’atomo ha una sottostruttura. Thomson stesso disse: “Fu solo quando fui convinto che l’esperimento non lasciava scampo che pubblicai la mia credenza nell’esistenza di corpi più piccoli degli atomi.”
Thomson tentò di misurare la carica dei singoli elettroni, ma il suo metodo poteva determinare la sua carica solo all’ordine di grandezza previsto.
Dagli esperimenti di Faraday con la galvanizzazione nel 1830, era noto che circa 100.000 C per mole erano necessari per piastrare ioni ionizzati singolarmente., Dividendo questo per il numero di ioni per mole (cioè per il numero di Avogadro), che era approssimativamente noto, la carica per ion è stata calcolata per essere circa 1,6 × 10-19 C, vicino al valore effettivo.

Figura 5. Robert Millikan (credit: Unknown Author, via Wikimedia Commons)
Un fisico americano, Robert Millikan (1868-1953) (vedi Figura 5), decise di migliorare l’esperimento di Thomson per misurare il qe e alla fine fu costretto a provare un altro approccio, che ora è un classico esperimento eseguito dagli studenti., L’esperimento Millikan oil drop è mostrato in Figura 6.
Nell’esperimento Millikan oil drop, gocce sottili di olio vengono spruzzate da un atomizzatore. Alcuni di questi sono caricati dal processo e possono quindi essere sospesi tra piastre metalliche da una tensione tra le piastre. In questa situazione, il peso della goccia è bilanciato dalla forza elettrica:
m dropg = qe E

Figura 6., L’esperimento Millikan oil drop ha prodotto la prima misurazione diretta accurata della carica sugli elettroni, una delle costanti più fondamentali in natura. Le gocce fini di olio si caricano una volta spruzzate. Il loro movimento è osservato tra piastre metalliche con un potenziale applicato per opporsi alla forza gravitazionale. L’equilibrio delle forze gravitazionali ed elettriche consente il calcolo della carica su una goccia. La carica è trovata per essere quantizzata in unità di -1,6 × 10-19 C, determinando così direttamente la carica degli elettroni in eccesso e mancanti sulle gocce di olio.,
Il campo elettrico è prodotto dalla tensione applicata, quindi, E=\frac{V}{d}\\, e V è regolato per bilanciare il peso della goccia. Le gocce possono essere viste come punti di luce riflessa usando un microscopio, ma sono troppo piccole per misurare direttamente la loro dimensione e massa. La massa della goccia è determinata osservando quanto velocemente cade quando la tensione è spenta. Poiché la resistenza dell’aria è molto significativa per queste gocce submicroscopiche, le gocce più massicce cadono più velocemente delle meno massicce e sofisticati calcoli di sedimentazione possono rivelare la loro massa., L’olio è usato piuttosto che l’acqua, perché non evapora facilmente, e quindi la massa è quasi costante. Una volta che la massa della goccia è noto, la carica dell’elettrone è data riordinando l’equazione precedente:
\displaystyle{q}=\frac{m_{\text{goccia}}g}{E}=\frac{m_{\text{goccia}}gd}{V}\\,
dove d è la separazione delle piastre e V è la tensione che tiene il calo immobile. (La stessa goccia può essere osservata per diverse ore per vedere che è davvero immobile.,) Nel 1913 Millikan aveva misurato la carica dell’elettrone qe ad una precisione dell ‘ 1%, e lo migliorò di un fattore 10 nel giro di pochi anni fino ad un valore di -1,60 × 10-19 C. Osservò anche che tutte le cariche erano multipli della carica elettronica di base e che potevano verificarsi cambiamenti improvvisi in cui gli elettroni venivano aggiunti o rimossi dalle gocce. Per questa fondamentale misurazione diretta del qe e per i suoi studi sull’effetto fotoelettrico, Millikan ricevette il Premio Nobel per la Fisica nel 1923.,
Con la carica dell’elettrone nota e il rapporto carica-massa noto, la massa dell’elettrone può essere calcolata. È
\displaystyle{m}=\frac{q_e}{\left(\frac{q_e}{m_e}\right)}\\
Sostituendo i valori noti i rendimenti
\displaystyle{m}_e=\frac{-1.60\times10^{-19}\text{ C}}{-1.76\times10^{11}\text{ C/kg}}\\
o me = 9.11 × 10-31 kg (elettroni di massa), dove gli errori di arrotondamento sono stati corretti., La massa dell’elettrone è stata verificata in molti esperimenti successivi ed è ora nota con una precisione migliore di una parte su un milione. È una massa incredibilmente piccola e rimane la più piccola massa nota di qualsiasi particella che abbia massa. (Alcune particelle, come i fotoni, sono senza massa e non possono essere portate a riposo, ma viaggiano alla velocità della luce.) Un calcolo simile fornisce le masse di altre particelle, incluso il protone. A tre cifre, la massa del protone è ora nota per essere mp = 1,67 × 10-27 kg (massa del protone), che è quasi identica alla massa di un atomo di idrogeno., Quello che Thomson e Millikan avevano fatto era quello di dimostrare l’esistenza di una sottostruttura di atomi, l’elettrone, e ulteriormente per dimostrare che aveva solo una piccola frazione della massa di un atomo. Il nucleo di un atomo contiene la maggior parte della sua massa e la natura del nucleo era completamente imprevista.
Anche un’altra importante caratteristica della meccanica quantistica stava cominciando ad emergere. Tutti gli elettroni sono identici tra loro. La carica e la massa degli elettroni non sono valori medi; piuttosto, sono valori unici che tutti gli elettroni hanno., Questo è vero per altre entità fondamentali a livello submicroscopico. Tutti i protoni sono identici tra loro e così via.
Il nucleo
Qui, esaminiamo la prima prova diretta della dimensione e della massa del nucleo. Nei capitoli successivi, esamineremo molti altri aspetti della fisica nucleare, ma le informazioni di base sulla dimensione e la massa nucleare sono così importanti per comprendere l’atomo che lo consideriamo qui.
La radioattività nucleare fu scoperta nel 1896 e fu presto oggetto di intensi studi da parte di alcuni dei migliori scienziati del mondo., Tra questi c’era il neozelandese Lord Ernest Rutherford, che fece numerose scoperte fondamentali e si guadagnò il titolo di “padre della fisica nucleare.”Nato a Nelson, Rutherford ha fatto i suoi studi post-laurea presso i laboratori Cavendish in Inghilterra prima di prendere una posizione presso la McGill University in Canada, dove ha fatto il lavoro che gli è valso un premio Nobel per la chimica nel 1908. Nell’area della fisica atomica e nucleare, c’è molta sovrapposizione tra chimica e fisica, con la fisica che fornisce le teorie abilitanti fondamentali., Tornò in Inghilterra negli anni successivi e aveva sei futuri vincitori del premio Nobel come studenti. Rutherford utilizzò le radiazioni nucleari per esaminare direttamente le dimensioni e la massa del nucleo atomico. L’esperimento da lui ideato è mostrato nella Figura 7. Una sorgente radioattiva che emette radiazioni alfa è stata posta in un contenitore di piombo con un foro su un lato per produrre un fascio di particelle alfa, che sono un tipo di radiazione ionizzante espulsa dai nuclei di una sorgente radioattiva., Una sottile lamina d’oro è stata posta nel raggio e la dispersione delle particelle alfa è stata osservata dal bagliore che hanno causato quando hanno colpito uno schermo di fosforo.

Figura 5. L’esperimento di Rutherford ha fornito prove dirette per la dimensione e la massa del nucleo sparpagliando particelle alfa da una sottile lamina d’oro. Le particelle alfa con energie di circa 5MeV sono emesse da una sorgente radioattiva (che è un piccolo contenitore metallico in cui è sigillata una quantità specifica di un materiale radioattivo), sono collimate in un raggio e cadono sulla lamina., Il numero di particelle che penetrano nella lamina o si disperdono a vari angoli indica che i nuclei d’oro sono molto piccoli e contengono quasi tutta la massa dell’atomo d’oro. Ciò è particolarmente indicato dalle particelle alfa che si disperdono ad angoli molto grandi, proprio come un pallone da calcio che rimbalza sulla testa di un portiere.,
Le particelle alfa erano note per essere i nuclei positivi doppiamente carichi di atomi di elio che avevano energie cinetiche dell’ordine di 5 MeV quando emesse nel decadimento nucleare, che è la disintegrazione del nucleo di un nuclide instabile mediante l’emissione spontanea di particelle cariche. Queste particelle interagiscono con la materia principalmente attraverso la forza di Coulomb, e il modo in cui si disperdono dai nuclei può rivelare dimensioni e massa nucleari. Questo è analogo a osservare come una palla da bowling è sparsa da un oggetto che non si può vedere direttamente., Poiché l’energia della particella alfa è così grande rispetto alle energie tipiche associate agli atomi (MeV contro eV), ci si aspetterebbe che le particelle alfa si schiantino semplicemente attraverso una lamina sottile come una palla da bowling supersonica si schianterebbe attraverso poche decine di file di birilli. Thomson aveva immaginato l’atomo di essere una piccola sfera in cui uguali quantità di carica positiva e negativa sono stati distribuiti in modo uniforme. L’incidente particelle alfa massicce subirebbero solo piccole deflessioni in un tale modello., Invece, Rutherford ei suoi collaboratori hanno scoperto che le particelle alfa occasionalmente sono stati sparsi a grandi angoli, alcuni anche indietro nella direzione da cui provenivano! L’analisi dettagliata utilizzando la conservazione della quantità di moto e di energia—in particolare del piccolo numero che è venuto subito indietro—implicava che i nuclei d’oro sono molto piccoli rispetto alle dimensioni di un atomo d’oro, contengono quasi tutta la massa dell’atomo e sono strettamente legati. Poiché il nucleo d’oro è molte volte più massiccio della particella alfa, una collisione frontale disperderebbe la particella alfa direttamente verso la sorgente., Inoltre, più piccolo è il nucleo, meno particelle alfa che colpirebbero una testa.
Sebbene i risultati dell’esperimento siano stati pubblicati dai suoi colleghi nel 1909, Rutherford impiegò due anni per convincersi del loro significato. Come Thomson prima di lui, Rutherford era riluttante ad accettare tali risultati radicali. La natura su piccola scala è così diversa dal nostro mondo classico che anche quelli in prima linea nella scoperta sono a volte sorpresi. Rutherford in seguito scrisse: “Era quasi incredibile come se avessi sparato un guscio da 15 pollici contro un pezzo di carta velina e fosse tornato indietro e ti avesse colpito., In considerazione, mi sono reso conto che questa dispersione all’indietro . . . . . . la maggior parte della massa dell’atomo era concentrata in un piccolo nucleo.”
Nel 1911, Rutherford pubblicò la sua analisi insieme a un modello proposto dell’atomo. La dimensione del nucleo è stata determinata per essere circa 10-15 m, o 100.000 volte più piccola dell’atomo. Ciò implica un’enorme densità, dell’ordine di 1015 g/cm3, molto diversa da qualsiasi materia macroscopica. È implicita anche l’esistenza di forze nucleari precedentemente sconosciute per contrastare le enormi forze di Coulomb repulsive tra le cariche positive nel nucleo., Forze enormi sarebbero anche coerenti con le grandi energie emesse nelle radiazioni nucleari.

Figura 8. Una visione estesa degli atomi nella lamina d’oro nell’esperimento di Rutherford. I cerchi rappresentano gli atomi (circa 10-10 m di diametro), mentre i punti rappresentano i nuclei (circa 10-15 m di diametro). Per essere visibili, i punti sono molto più grandi della scala. La maggior parte delle particelle alfa si schiantano ma sono relativamente inalterate a causa della loro alta energia e della piccola massa dell’elettrone., Alcuni, tuttavia, si dirigono dritti verso un nucleo e sono sparsi all’indietro. Un’analisi dettagliata fornisce la dimensione e la massa del nucleo.
La piccola dimensione del nucleo implica anche che l’atomo è per lo più vuoto all’interno. Infatti, nell’esperimento di Rutherford, la maggior parte degli alpha è passata direttamente attraverso la lamina d’oro con pochissima dispersione, poiché gli elettroni hanno masse così piccole e poiché l’atomo era per lo più vuoto senza che l’alfa colpisse., C’erano già indizi di questo al momento Rutherford eseguito i suoi esperimenti, dal momento che gli elettroni energetici erano stati osservati per penetrare fogli sottili più facilmente del previsto. La figura 8 mostra uno schema degli atomi in un foglio sottile con cerchi che rappresentano la dimensione degli atomi (circa 10-10 m) e punti che rappresentano i nuclei. (I punti non sono in scala-se lo fossero, si avrebbe bisogno di un microscopio per vederli.) La maggior parte delle particelle alfa manca i piccoli nuclei e sono solo leggermente disperse dagli elettroni., Occasionalmente, (circa una volta ogni 8000 volte nell’esperimento di Rutherford), un alfa colpisce un nucleo frontalmente e viene sparso dritto all’indietro.

Figura 9. Il modello planetario dell’atomo di Rutherford incorpora le caratteristiche del nucleo, degli elettroni e delle dimensioni dell’atomo. Questo modello fu il primo a riconoscere la struttura degli atomi, in cui gli elettroni a bassa massa orbitano attorno a un nucleo molto piccolo e massiccio in orbite molto più grandi del nucleo. L’atomo è per lo più vuoto ed è analogo al nostro sistema planetario.,
In base alle dimensioni e alla massa del nucleo rivelate dal suo esperimento, così come alla massa di elettroni, Rutherford propose il modello planetario dell’atomo. Il modello planetario dell’atomo raffigura elettroni a bassa massa che orbitano attorno a un nucleo di grande massa. Le dimensioni delle orbite degli elettroni sono grandi rispetto alle dimensioni del nucleo, con la maggior parte del vuoto all’interno dell’atomo. Questa immagine è analoga a come i pianeti a bassa massa nel nostro sistema solare orbitano attorno al Sole di grande massa a distanze grandi rispetto alle dimensioni del sole., Nell’atomo, la forza di Coulomb attraente è analoga alla gravitazione nel sistema planetario. (Vedi Figura 9.) Si noti che è necessario un modello o un’immagine mentale per spiegare i risultati sperimentali, poiché l’atomo è troppo piccolo per essere osservato direttamente con la luce visibile.
Il modello planetario dell’atomo di Rutherford è stato cruciale per comprendere le caratteristiche degli atomi, le loro interazioni e le loro energie, come vedremo nelle prossime sezioni. Inoltre, era un’indicazione di quanto la natura sia diversa dal mondo classico familiare sulla piccola scala meccanica quantistica., La scoperta di una sottostruttura per tutta la materia sotto forma di atomi e molecole stava ora facendo un ulteriore passo avanti per rivelare una sottostruttura di atomi che era più semplice dei 92 elementi allora conosciuti. Abbiamo continuato a cercare sottostrutture più profonde, come quelle all’interno del nucleo, con un certo successo. Nei capitoli successivi, seguiremo questa ricerca nella discussione dei quark e di altre particelle elementari, e esamineremo la direzione in cui la ricerca sembra ora dirigersi.,
PhET Explorations: Rutherford Scattering
Come ha fatto Rutherford a capire la struttura dell’atomo senza essere in grado di vederlo? Simula il famoso esperimento in cui ha smentito il modello di budino di prugne dell’atomo osservando le particelle alfa che rimbalzano sugli atomi e determinando che devono avere un piccolo nucleo.
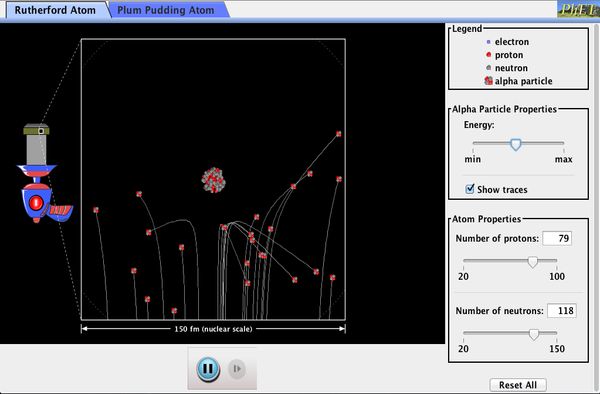
Fare clic per scaricare la simulazione. Esegui usando Java.,
Riepilogo della sezione
Problemi& Esercizi
- Rutherford trovò che la dimensione del nucleo era di circa 10-15 m. Ciò implicava un’enorme densità. Quale sarebbe questa densità per l’oro?
- Nell’esperimento oil-drop di Millikan, si guarda una piccola goccia di olio tenuta immobile tra due piastre. Prendi la tensione tra le piastre per essere 2033 V e la separazione della piastra per essere 2,00 cm. La goccia d’olio (di densità 0,81 g/cm3) ha un diametro di 4,0 × 10-6 m. Trova la carica sulla goccia, in termini di unità di elettroni.,
- (a) Un aspirante fisico vuole costruire un modello in scala di un atomo di idrogeno per il suo progetto science fair. Se l’atomo ha un diametro di 1,00 m, quanto dovrebbe provare a fare il nucleo? (b) Quanto sarà facile farlo?