Che cos’è la volatilità?
Si dice che una sostanza sia volatile se bolle a bassa temperatura, passando dalla fase liquida a quella gassosa.
Le sostanze che sono gas a temperatura ambiente sono estremamente volatili: hanno un’elevata volatilità. Possono essere visti solo come liquidi se esposti a basse temperature o alte pressioni.
La tabella seguente mostra alcune sostanze disposte in ordine decrescente di punto di ebollizione e crescente volatilità., Nella tabella, il boro è il meno volatile e l’idrogeno la sostanza più volatile.,

Volatility and Vapor Pressure
At the molecular level, particles in liquids have a range of kinetic energies.,Le particelle più energetiche hanno abbastanza energia per uscire dal liquido ed entrare nella fase gassosa. Vediamo questo come evaporazione.
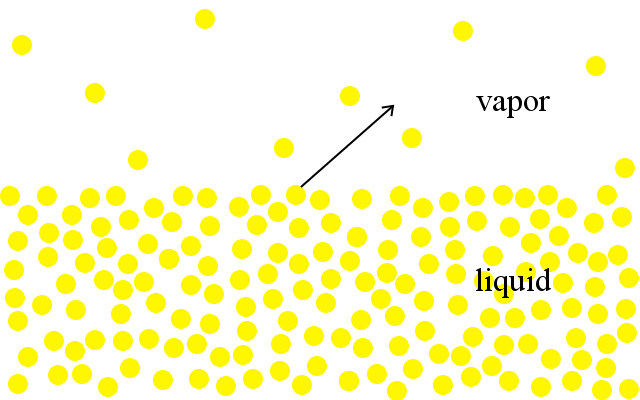
Un liquido bolle quando la pressione delle sue particelle che entrano nella fase gassosa sale alla pressione atmosferica circostante.
Più un liquido è vicino al suo punto di ebollizione, maggiore è la sua pressione di vapore.I liquidi con bassi punti di ebollizione hanno pressioni di vapore più elevate a qualsiasi temperatura rispetto ai liquidi con alti punti di ebollizione.
Pertanto, ad esempio, l’acetone con un punto di ebollizione di 56 °C ha una pressione di vapore più elevata rispetto all’acqua.,A temperatura ambiente, l’acetone entrerà nella fase vapore in misura maggiore dell’acqua.Questa è una caratteristica dei liquidi volatili.