RISPOSTA LUNGA. In primo luogo, una distinzione deve essere fatta tra la polarità di un legame e la polarità di una molecola (o composto).
La polarità del legame si riferisce a una separazione della carica elettrica che deriva da una differenza di elettronegatività tra i due atomi o gruppi che si legano insieme.,
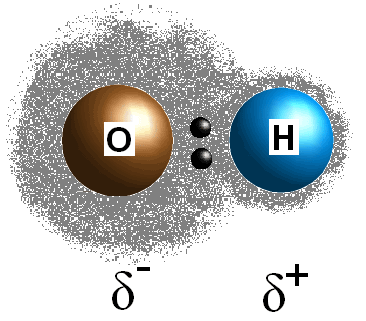
Questa differenza nei valori di elettronegatività tra i due atomi fa sì che gli elettroni del legame siano condivisi in modo disuguale, creando così una carica postiva (#delta^+#) sull’atomo meno elettronegativo e una carica negativa parziale (#delta^(-)#) sull’atomo più elettronegativo. La polarità di un legame può essere determinata utilizzando esclusivamente i valori di elettronegatività dei due atomi costituenti.
Se il legame tra i due atomi non è polare, cioè la differenza di elettronegatività tra i due atomi è inferiore a 0.,5, quindi la molecola sarà non polare. Se il legame è davvero polare, puoi procedere per cercare di determinare la polarità della molecola.
La geometria di una molecola è un fattore importante nel determinare la polarità di una molecola. Queste suddette cariche parziali danno origine a un momento di dipolo del legame, # mu#.
Se gli orientamenti di questi momenti di dipolo del legame si annullano a vicenda, si dice che la molecola sia non polare. Se tuttavia non lo fanno, hai a che fare con una molecola polare.,
Alcuni esempi in cui i momenti di dipolo del legame si annullano a vicenda, risultando in una molecola non polare:
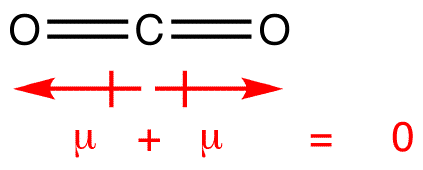
I momenti di dipolo vengono disegnati con la freccia rivolta verso l’atomo più elettronegativo e il lato positivo sull’atomo meno elettronegativo. Si noti che per # CO_2#, che ha due legami polari, il momento di dipolo complessivo è zero, poiché queste due frecce si annullano a vicenda. Ciò si traduce in una molecola non polare., Lo stesso si può dire per #BF_3#:
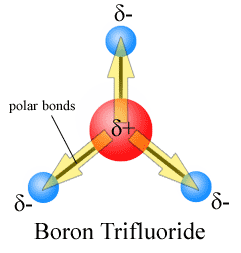
I tre momenti di dipolo si annullano a vicenda come risultato della disposizione simmetrica dei legami (vedi altro su aggiunta vettoriale).
Una disposizione asimmetrica delle cariche parziali risulta in una molecola polare, come si può vedere per l’acqua:
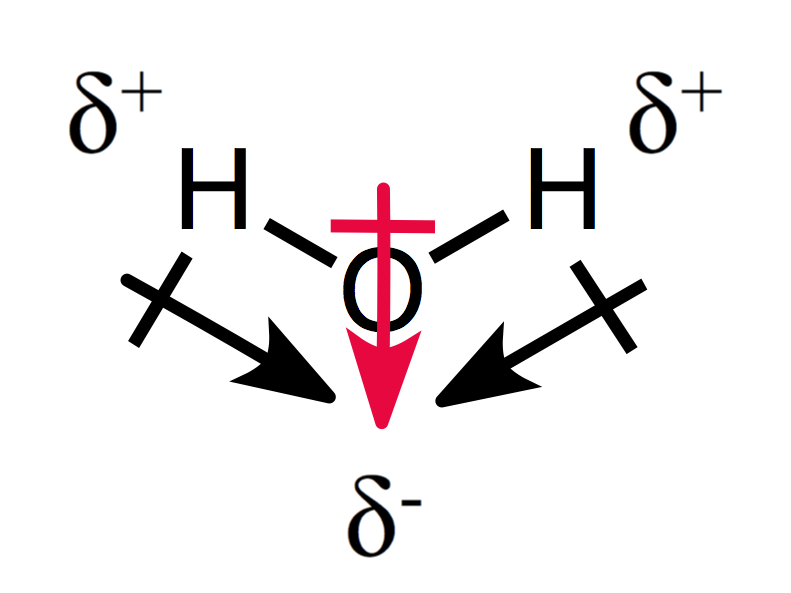
I due momenti di dipolo si aggiungono l’uno all’altro creando un momento di dipolo complessivo, e quindi una molecola polare.,
In conclusione, per prevedere la polarità di una molecola, è necessario avere familiarità con le strutture di Lewis, l’elettronegatività, la Teoria VSEPR e la polarità del legame.