Una titolazione è una tecnica volumetrica in cui una soluzione di un reagente (il titolante) viene aggiunta a una soluzione di un secondo reagente (l ‘ “analita”) fino al raggiungimento del punto di equivalenza. Il punto di equivalenza è il punto in cui il titolante è stato aggiunto esattamente nella giusta quantità per reagire stechiometricamente con l’analita (quando moli di titolante = moli di analita). Se il titolante o l’analita sono colorati, il punto di equivalenza è evidente dalla scomparsa del colore man mano che i reagenti vengono consumati., In caso contrario, un indicatore può essere aggiunto che ha un “endpoint” (cambia colore) al punto di equivalenza, o il punto di equivalenza può essere determinato da una curva di titolazione. La quantità di titolante aggiunto è determinata dalla sua concentrazione e volume:
n (mol) = C (mol/L) * V (L)
e la quantità di titolante può essere utilizzata nel solito calcolo stechiometrico per determinare la quantità di analita.
Il processo di titolazione può essere osservato nel video qui sotto.,
Un volume misurato della soluzione da titolare, in questo caso, acido acetico acquoso incolore, CH3COOH(aq) viene posto in un becher. L’idrossido di sodio incolore NaOH (aq), che è il titolante, viene aggiunto con attenzione per mezzo di una buretta. Il volume di titolante aggiunto può quindi essere determinato leggendo il livello di liquido nella buretta prima e dopo la titolazione. Questa lettura di solito può essere stimata al centesimo di millilitro più vicino, così precise aggiunte di titolante possono essere fatte rapidamente.,
Mentre i primi millilitri di titolante fluiscono nel pallone, alcuni indicatori cambiano brevemente in rosa, ma tornano rapidamente incolori. Ciò è dovuto a un grande eccesso di acido acetico. Il reagente limitante NaOH è interamente consumato.
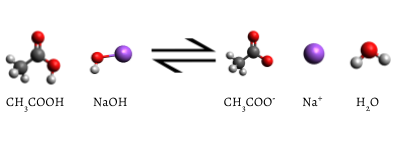
L’indicatore aggiunto diventa rosa quando la titolazione è completa, indicando che tutto l’acido acetico acquoso è stato consumato da NaOH(aq). La reazione che si verifica è
\
Alla fine, tutto l’acido acetico viene consumato., L’aggiunta anche di una frazione di una goccia di titolante produce un colore rosa duraturo a causa del NaOH non reagito nel pallone. Il cambiamento di colore che si verifica all’endpoint dell’indicatore segnala che tutto l’acido acetico è stato consumato, quindi abbiamo raggiunto il punto di equivalenza della titolazione. Se fosse stata aggiunta una soluzione leggermente più NaOH, ci sarebbe stato un eccesso e il colore della soluzione nel pallone sarebbe diventato molto più scuro. L’endpoint appare improvvisamente e si deve prestare attenzione a non superare l’endpoint.
Dopo che la titolazione ha raggiunto l’endpoint, viene letto un volume finale dalla buret., Utilizzando la lettura iniziale e finale, il volume aggiunto può essere determinato in modo abbastanza preciso:
Lo scopo di una titolazione è sempre quello di aggiungere solo la quantità di titolante necessaria per consumare esattamente la quantità di sostanza titolata. Nella reazione NaOH-CH3COOH Eq. \(\ref{2}\), il punto di equivalenza si verifica quando una quantità molare uguale di NaOH è stata aggiunta dal cilindro graduato per ogni mole di CH3COOH originariamente nel pallone di titolazione., Cioè, al punto di equivalenza il rapporto tra la quantità di NaOH, aggiunto alla quantità di CH3COOH consumato deve essere uguale al rapporto stechiometrico
\
La titolazione viene spesso utilizzata per determinare la concentrazione di una soluzione. In molti casi non è semplice ottenere una sostanza pura, pesarla accuratamente e scioglierla in un matraccio tarato come è stato fatto nell’esempio 1 delle concentrazioni di soluzione. NaOH, ad esempio, si combina rapidamente con H2O e CO2 dall’aria, e quindi anche un campione appena preparato di NaOH solido non sarà puro., Il suo peso cambierebbe continuamente come CO2(g) e H2O (g) sono stati assorbiti. Il cloruro di idrogeno (HCl) è un gas a temperature e pressioni ordinarie, che lo rendono molto difficile da maneggiare o pesare. Le soluzioni acquose di entrambe queste sostanze devono essere standardizzate; cioè, le loro concentrazioni devono essere determinate mediante titolazione.
Di gran lunga l’uso più comune delle titolazioni è nel determinare le incognite, cioè nel determinare la concentrazione o la quantità di sostanza in un campione di cui inizialmente non sapevamo nulla. Il prossimo esempio riguarda uno sconosciuto che molte persone incontrano ogni giorno.,
I 308,0 mg ottenuti in questo esempio sono in accordo ragionevolmente stretto con la richiesta del produttore di 300 mg. Le compresse sono timbrate dalle macchine, non pesate individualmente, e quindi è prevista qualche variazione.