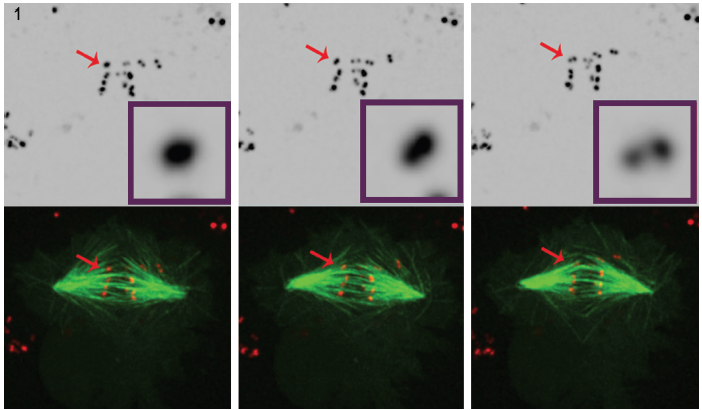
1.ábra. Három Kiválasztott képek egy filmből, a POLO-szegényített sejtek egyértelműen azt mutatják, hogy az idő múlásával, intenzív centromere/kinetochore jelet (piros) megoldja egy pár pont, amely azt mutatja, hogy a kromoszómák vagy syntelically csatolt orsó mikrotubulusaival (zöld). A 4D fluoreszcens mikroszkópos adatkészleteket 30 másodpercenként gyűjtöttük össze 0-val.,5 mm-es z-lépések, amelyek a teljes cellatérfogat egy 100°, 1.4 NA terv-apokromatikus célkitűzés 25°C-on Andor forradalom spinning disk confocal egység és iXon EMCCD kamera, mindkettő által vezérelt Andor IQ live-cell képalkotó szoftver.
a mitotikus sejtosztódás a sejtek azon képességére támaszkodik, hogy megfelelően elosztják a testvérkromatidokat alkotó sejtekké. A funkció megbízható végrehajtásához a sejtek belső szerkesztési mechanizmusokat használnak a pontatlan kromoszóma / orsó szálas mellékletek kijavítására., Párosított kinetochores általában igazodik megfelelően csatolja orsó rostok és elkülöníteni kromatin, azonban hibás és rosszul kinetochores do eredmény. A cellák speciális szerkesztési mechanizmusokat tartalmaznak, hogy megakadályozzák és kijavítsák ezeket a rosszul beállított kinetochore párokat, bár a pontos mechanizmus nem jól ismert 1,2 ., Tatiana Moutinho-Santos, a portugál Instituto de Biologia Molecular e Celular (IBMC) Universidade do Porto posztulálja, hogy a POLO kináz jelenléte szükséges a kromoszóma bi-orientációjának (úgynevezett amfitelikus elrendezés) elősegítéséhez, ezáltal megőrizve a megfelelő kinetochore-igazítást.
a kinetochore fejlődésének szabályozásában betöltött szerepének jobb megértése érdekében Dr. Moutinho dos Santos tanulmányozta a kimerült Drosophila POLO kinázt az élő sejtekben, hogy igazolja POLO részvételét az amphitelic kinetochore elrendezésének fenntartásához szükséges szerkesztési funkciókban., Ebben az esetben a szinelikus elrendezést (ugyanazon orsóból származó mikrotubulusokhoz kapcsolódó testvér kinetochores) tanulmányozták. Timelapse elemzés a mitózis végezték a Drosophila S2 sejtek stabilan expresszáló CID-mCherry a vizualizáció, a centromert, valamint a GFP-egy-végbemenő a mikrotubulusaival. A kinetochorok vizualizációja a kis méretük, alacsony fluoreszkáló jelük és a sejtosztódás során fellépő rövid megjelenésük miatt igényes. A konfokális fluoreszcens mikroszkópiát gyakran használják a kinetochores képére, azonban még ebben a környezetben is nehéz a vizualizáció., A kinetochores nagyon kicsi (300 nm) 3, közel van a fénymikroszkóp oldalirányú felbontóképességéhez, és meghaladja a mikroszkóp axiális felbontóképességét. Ezenkívül az élő sejteken belüli képalkotó fluoreszcens markerek potenciális fototoxikus és fotobleaching hatást fejtenek ki. Az intenzív lézeres megvilágítás fototoxicitási problémákat okozhat, különösen káros az élő, osztódó sejtek számára.
Andor forradalma XD spinning disk confocal mikroszkópiát alkalmaz Dr. Moutinho dos Santo egyedülálló kihívásának leküzdésére, amely a kinetochores megfigyelésével kapcsolatos., Ebben az esetben négy különböző tényezőt kell egyszerre foglalkozni, hogy megfelelően elképzelni, hogy a dinamikus sejtszintű folyamatok:
- Sebesség megszerzése
- Térbeli, illetve időbeli megoldásának képessége
- A képességét, hogy érzékelje nagyon alacsony fluoreszcencia intenzitás szint
- Gazdálkodás a rendelkezésre álló fluoreszcens jel
Ezek a témák a térbeli, időbeli, valamint intenzitás felbontás gyakran ismétlődnek a fluoreszcencia mikroszkópia, gyakran ellentétes érintő kísérletek a megfigyelés, a sejtek életképességét., Például a hosszú fényképezőgép-expozíció és a nagy intenzitású megvilágítás hosszabb ideig tartó fototoxikus hatásai károsítják vagy elpusztítják az élő sejteket. Ezzel párhuzamosan az enyhén címkézett mikrostruktúrák hosszabb expozíciót igényelnek a megjelenítéshez, de hátrányosan befolyásolhatják a fotobleaching. A kérdés összeállítása az, hogy össze kell kapcsolni a hagyományos háromdimenziós adatokat az idővel. Végül, továbbra is szükség van, hogy észre jelet háttérzaj és outof-fókusz köd.
Az akvizíció sebessége különösen fontos Dr. Mountinho dos Santos számára., A kontroll S2 sejtek körülbelül 30 perces osztódási ciklust mutatnak. A POLO kimerült S2 sejtjei azonban kísérleteiben nyolc órát meghaladó letartóztatási időszakot mutattak. A felvétel a POLO szegényített sejtosztódást igényel gyűjteménye között 7,200, valamint 12,000 kép készletek (két fluorochromes rajzolódik minden harminc másodperc alatt egy öt óra szerzett 0,5 mikron axiális lépéseket, legfeljebb 20 lépés axiális kinetochore állásfoglalás)., A hagyományos fluoreszcens mikroszkópia és lézeres megvilágítás sem a szükséges finom megvilágítási követelményeket, sem az akvizíció sebességét nem teszi lehetővé az időérzékeny feladat elvégzéséhez. Például a hagyományos konfokális mikroszkópiában a lézeres raszterelés hosszabb időt igényel a minta jelének összegyűjtéséhez. A Spinning disk confocal rendszereket arra használják, hogy legyőzzék ezeket a hagyományos akadályokat, és új betekintést nyújtsanak a molekuláris kinetochore szerkesztési technikákba.,
a hagyományos widefield fluoreszcens rendszerekhez képest a spinning disk confocal térbeli felbontása mind az oldalsó (x és y), mind az axiális (z) dimenziókban jobb. A pinhole tömb állandó szkennelésével a minták valós időben, nagy kontrasztban tekinthetők meg, tiszta képeket biztosítva a mikroszkóp optikájának diffrakciós határain. Ez lehetővé teszi a dinamikus kinetochore viselkedés 3D-s megjelenítését, megértését az orsó mikrotubulusaival kapcsolatban., A 300 nm-es Kinetochore és centromere oldalfelbontást és 300-500 nm-es orsó szálfelbontást jelentették, és az A.
Intenzitásfelbontás
Az egyes centromerekhez kapcsolódó fluoreszcens címkével ellátott kinetochores megjelenítése további követelményeket támaszt az akvizíciós rendszerrel szemben. A vizsgált centromerek és kinetochorok elsősorban csak a sejtosztódás interphase során láthatók. Ahogy a sejtek áthaladnak a prophase-en, a centromerek már megoldódtak a Drosophila tipikus tizenkét kromoszómapárjába., A rendelkezésre álló fényköltségvetés kezelése hosszadalmas beszerzés során szelíd megvilágítást és nagy felbontást tesz szükségessé, amely képes a lemez technikáinak forgatására. A forgó lemezegységen belüli nyílások biztosítják ezeket az előnyöket. Mivel a fény csak akkor izgatja a fluorofórokat, ha nyílás van jelen, a fototoxikus hatások minimalizálódnak. Míg az ellenintuitív, a csökkentett fényköltség nem jelzi a gyenge, nehezen észlelhető tárgyakat. Az intenzitás felbontását növeli a forgó lemez kizárása a fókusz jelből, majd az EMCCD kamera architektúrájának későbbi jelerősítése., Ez megteremti az új lehetőséget arra, hogy nagyobb kontrasztú képeket generáljunk, amelyek feltárják a pontos objektumok, például a kinetochores fejlődését és összehangolását.
következtetések
a spinning disk technológia használata Dr. Mountinho dos Santos élő cellás alkalmazásban fontos megfigyeléshez vezetett. A POLO kináz hiányában a Drosophila sejtekről kimutatták, hogy hiányoznak az amphitelikus kromoszóma elrendezésének fenntartásához szükséges korrekciós mechanizmusok., A POLO jelenléte megmutatta, hogy a megfelelő környezetet biztosítja a megfelelő centromere architektúrához, ugyanakkor biztosítja a megfelelő kromoszóma BI-orientációt. A Polo kináz kromoszómák hiányában mitózisban szenvedő tenyésztett Drosophila sejtek szinelikus orientációjú orsószálakhoz kapcsolódnak,azaz a testvér kinetochorokhoz, amelyek egyetlen orsó pólusból származnak.
ezt a következtetést a fluoreszcens címkével ellátott centromere/ kinetochore markereket és mikrotubulusokat expresszáló sejtekben végzett 4D fluoreszcens mikroszkópia alapos elemzésével vonták le. (1. ábra).