Membrán Fehérjék
Míg a lipidek az alapvető szerkezeti elemei membránok, fehérjék elvégzéséért felelős specifikus membrán funkció. A legtöbb plazmamembrán körülbelül 50% lipidből és 50% fehérjéből áll, a glikolipidek és glikoproteinek szénhidrátrészei a membrántömeg 5-10% – át teszik ki. Mivel a fehérjék sokkal nagyobbak, mint a lipidek, ez a százalék körülbelül egy fehérjemolekulának felel meg minden 50-100 lipidmolekulánként., 1972-ben Jonathan Singer és Garth Nicolson javasolta a membránszerkezet folyékony mozaikmodelljét, amelyet ma már általánosan elfogadnak az összes biológiai membrán megszervezésének alapvető paradigmájaként. Ebben a modellben a membránokat kétdimenziós folyadékoknak tekintik, amelyekben a fehérjéket lipid kétrétegekbe helyezik (12.3 ábra).

12.3
a plazmamembrán Folyadékmozaik modellje., Az integrált membránfehérjék a lipid kétrétegbe kerülnek, míg a perifériás fehérjék a fehérjefehérje-kölcsönhatások révén közvetetten kötődnek a membránhoz. A legtöbb szerves membránfehérje transzmembrán (több…)
Singer és Nicolson a membránhoz kapcsolódó fehérjék két osztályát különböztették meg, amelyeket perifériás és integrált membránfehérjéknek neveztek., A perifériás membránfehérjéket olyan fehérjékként definiálták, amelyek poláris reagensekkel végzett kezeléseket követően, például extrém pH-vagy magas sókoncentrációjú oldatokkal disszociálnak a membránról, amelyek nem zavarják a foszfolipid kétréteget. A membrántól való disszociáció után a perifériás membránfehérjék vizes pufferekben oldódnak. Ezek a fehérjék nem kerülnek be a lipid kétrétegű hidrofób belsejébe. Ehelyett közvetetten kapcsolódnak a membránokhoz fehérje-fehérje kölcsönhatások révén., Ezek a kölcsönhatások gyakran ionos kötéseket tartalmaznak, amelyeket extrém pH vagy magas só zavar.
a perifériás membránfehérjékkel ellentétben az integrált membránfehérjék csak olyan kezelésekkel szabadul fel, amelyek megzavarják a foszfolipid kétréteget. Ezeknek az integrált membránfehérjéknek a részeit behelyezzük a lipid kétrétegbe, így csak olyan reagensekkel lehet disszociálni, amelyek megzavarják a hidrofób kölcsönhatásokat., Az integrált membránfehérjék szolubilizálására leggyakrabban használt reagensek a mosószerek, amelyek kis amfipatikus molekulák, amelyek mind hidrofób, mind hidrofil csoportokat tartalmaznak (12.4 ábra). A mosószerek hidrofób részei kiszorítják a membrán lipidjeit, és az integrált membránfehérjék hidrofób részeihez kötődnek. Mivel a mosószer molekula másik vége hidrofil, a mosószer-fehérje komplexek vizes oldatokban oldódnak.

12.4
szerves membránfehérjék mosószerekkel történő oldása., A mosószerek (pl. oktil-glükozid) hidrofil fejcsoportokat és hidrofób farkakat tartalmazó amfipatikus molekulák. A hidrofób farok az integrált membrán hidrofób régióihoz kötődik (több…)
számos szerves fehérje transzmembrán fehérjék, amelyek a lipid kétréteget a membrán mindkét oldalán kitett részekkel fedik le. Ezeket a fehérjéket a plazmamembránok elektron mikrográfjaiban lehet megjeleníteni, amelyeket a fagyasztási törés technikájával készítenek (lásd az 1.35 ábrát). Ezekben a mintákban a membránt két szórólapra osztják., A transzmembrán fehérjék ezután részecskékként jelennek meg a membrán belső felületén (12.5 ábra).

12.5
az emberi vörösvértest membránjainak Fagyásálló elektronmikrográfja. A membránban lévő részecskék transzmembrán fehérjék. (Harold H. Edwards / Visuals Unlimited.,)
A membrán-átívelő részeit transzmembrán fehérjék általában α helices 20 25 hidrofób aminosavak, hogy helyezünk a membrán a leggyakoribb típusa szintézis során a polipeptid lánc (lásd a Számok 9.11, 9.12, valamint 9.13). Ezeket a fehérjéket ezután membránhólyagokban szállítják az endoplazmatikus retikulumból a Golgi készülékbe, onnan a plazmamembránba., Szénhidrát csoportok egészül ki, hogy a polipeptid láncok, mind a leggyakoribb típusa, valamint Golgi-készülék, így a legtöbb transzmembrán fehérjék a plazma membrán vagy glikoproteinek a oligoszacharidok téve a felszínen a sejt.
a vörösvérsejtekkel végzett vizsgálatok jó példákat mutattak mind a perifériás, mind az integrált fehérjékre, amelyek a plazmamembránhoz kapcsolódnak. Az emberi eritrociták membránjai körülbelül egy tucat fő fehérjét tartalmaznak, amelyeket eredetileg a membránkészítmények gélelektroforézisével azonosítottak., Ezek többsége olyan perifériás membránfehérje, amelyet a kortikális citoszkeleton összetevőjeként azonosítottak, amely a plazmamembrán alapját képezi, és meghatározza a sejt alakját (lásd a 11.fejezetet). Például a vörösvérsejtek legelterjedtebb perifériás membránfehérje a spektrin, amely az eritrociták fő citoszkeletális fehérje. A vörösvérsejtek egyéb perifériás membránfehérjéi közé tartozik az aktin, az ankyrin és a 4.1 sáv., Az Ankyrin a plazmamembrán és a citoszkeleton közötti fő kapcsolatot a spektrin és az integral membránfehérje 3-as sávjához való kötődéssel biztosítja (lásd a 11.11.ábrát). A membrán és a citoszkeleton közötti további kapcsolatot a 4.1 sáv biztosítja, amely a spektrin és az aktin csomópontjaihoz, valamint a glikoforinhoz (az eritrociták másik fő szerves membránfehérje) kötődik.
a vörösvértestek két fő szerves membránfehérje, a glikoforin és a 3. sáv jól tanulmányozott példákat nyújt a transzmembrán fehérje szerkezetére (12.6 ábra)., A glikoforin egy 131 aminosavból álló kis glikoprotein, amelynek molekulatömege körülbelül 30 000, amelynek fele fehérje és fél szénhidrát. A glikoforin egyetlen membránon keresztezi a membránt-23 aminosavból álló α hélix, a glikozilált amino-terminális része a sejt felületén van kitéve. Bár a glikoforin volt az egyik első transzmembrán fehérje, amelyet jellemeztek, pontos funkciója ismeretlen. Ezzel szemben a vörösvérsejtek másik fő transzmembrán fehérje funkciója jól ismert., Ez a fehérje, eredetileg band 3 néven ismert, az anion transzporter, amely felelős a bikarbonát (HCO3-) és a klorid (Cl-) ionok átjutásáért a vörösvértest membránján. A band 3 polipeptidlánc 929 aminosav, és úgy gondolják, hogy 14 membránon átívelő α-spirális régiója van. A membránon belül a 3-as sáv dimerjei gömb alakú szerkezeteket képeznek, amelyek belső csatornákat tartalmaznak, amelyeken keresztül az ionok képesek átjutni a lipid kétrétegen.
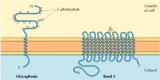
12.6
a vörösvértestek szerves membránfehérjéi., A glikoforin (131 aminosav) egyetlen transzmembrán α helixet tartalmaz. Erősen gliokozilált, oligoszacharidokkal, amelyek a polipeptidlánc extracelluláris részében 16 helyhez kapcsolódnak. (több…)
amfipatikus jellegük miatt a transzmembrán fehérjék nehezen kristályosodnak, ahogy az a röntgen-diffrakcióval végzett háromdimenziós szerkezeti elemzéshez szükséges., Az első transzmembrán fehérje, amelyet röntgenkristallográfiával elemeztek, a rhodopseudomonas viridis baktérium fotoszintetikus reakcióközpontja volt, amelynek szerkezetét 1985-ben jelentették (12.7 ábra). A reakcióközpont három transzmembrán fehérjét tartalmaz, amelyeket L, M és H (könnyű, közepes és nehéz) jelöl a gélelektroforézissel jelzett látszólagos méretük szerint. Az L és M alegységek mindegyike öt membránon átívelő α hélixet tartalmaz. A H alegységnek csak egyetlen transzmembrán α helixje van, a polipeptidlánc nagy része a membrán citoszolikus oldalán., A reakcióközpont negyedik alegysége egy citokróm, amely a fehérje-fehérje kölcsönhatások által a komplexhez kötött perifériás membránfehérje.

12.7
a bakteriális fotoszintetikus reakcióközpont. A reakcióközpont három transzmembrán fehérjéből áll, amelyeket l (Piros), M (sárga) és H (zöld) jelöl. Az L és M alegységek mindegyike öt transzmembrán α hélixet tartalmaz, míg a H alegységnek csak (több…)
bár a legtöbb transzmembránfehérje α-spirális régiók szerint lefedi a membránt, ez nem mindig így van., A porinok jól jellemzett kivételt képeznek-olyan fehérjék egy csoportja, amelyek csatornákat képeznek egyes baktériumok külső membránjaiban. Számos baktérium, köztük az E. coli, kettős membránrendszerrel rendelkezik, amelyben a plazmamembránt (vagy a belső membránt) a sejtfal és egy különálló külső membrán veszi körül (12.8 ábra). A plazmamembránnal ellentétben a külső membrán nagyon áteresztő ionokra és kis poláris molekulákra (az E. coli esetében legfeljebb 600 molekulatömeggel). Ez a permeabilitás a porinokból származik, amelyek nyílt vizes csatornákat képeznek a lipid kétrétegen keresztül., Amint azt a 10. fejezet tárgyalja, a bakteriális porinokhoz kapcsolódó fehérjék a mitokondriumok és a kloroplasztok külső membránjaiban is megtalálhatók.
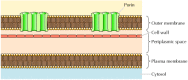
12.8
Egyes baktériumok plazmamembránját egy sejtfal és egy különálló külső membrán veszi körül. A külső membrán porinokat tartalmaz, amelyek nyílt vizes csatornákat képeznek, amelyek lehetővé teszik az ionok és a kis molekulák szabad áthaladását.
szerkezeti elemzés azt mutatta, hogy a porinok nem tartalmaznak hidrofób α-spirális régiókat., Ehelyett β-hordóként keresztezik a membránt, amelyben 16 β-lap egy vizes pórust körülvevő hordószerű szerkezetbe hajlik (12.9 ábra). A poláris aminosavak oldalláncai a pórust vonalozzák, míg a hidrofób aminosavak oldalláncai kölcsönhatásba lépnek a membrán belsejével. A porin monomerek stabil trimereket alkotnak, amelyek mindegyike három nyitott csatornát tartalmaz, amelyeken keresztül a poláris molekulák diffundálhatnak a membránon.

12,9
egy porin monomer szerkezete., Minden monomer egy β hordó, amely 16 antiparallel β szálból (nyilakból) áll. A molekula felső vége a külső közeg felé néz. (H. Nikaidótól, 1994. J. Biol. Chem. 269: 3905.)
a transzmembrán fehérjékkel ellentétben számos fehérjét (amelyek közül sokan szerves membránfehérjékként viselkednek) a plazmamembránba kovalensen csatolt lipidek vagy glikolipidek rögzítik (12.10 ábra). Ezeknek a fehérjéknek az egyik osztályának tagjait glikozilfoszfatidilinozit (GPI) horgonyokkal helyezzük be a plazmamembrán külső szórólapjába., GPI-horgonyokat adnak bizonyos fehérjékhez, amelyeket az endoplazmatikus retikulumba juttattak, és C-terminális transzmembrán régió rögzíti a membránban (lásd a 9.16.ábrát). A transzmembrán régió hasad, mivel a GPI horgonyt hozzáadják, így ezek a fehérjék csak a glikolipid által kapcsolódnak a membránhoz. Mivel a GPI-horgonyzott fehérjék polipeptidláncai az endoplazmatikus retikulumba kerülnek, glikoziláltak és a sejt felszínén vannak kitéve a plazmamembránba történő szállítás után.
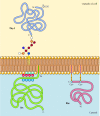
12.ábra.,10
példák a lipidek és glikolipidek által a plazmamembránba rögzített fehérjékre. Egyes fehérjék (pl. a limfocita fehérje Te-1) rögzítve a külső utasítás a plazma membrán által GPI horgonyok ki, hogy a C-terminus a leggyakoribb típusa. (több…)
más fehérjéket a plazmamembrán belső szórólapjában kovalensen csatolt lipidek rögzítenek. Ahelyett, hogy a szekréciós úton dolgoznák fel, ezeket a fehérjéket szabad citoszolos riboszómákon szintetizálják, majd lipidek hozzáadásával módosítják., Ezek a módosítások magukban foglalják a mirisztinsav (14-szén-zsírsav) hozzáadását a polipeptidlánc aminosavvégéhez, palmitinsav (16 karbon) hozzáadását a ciszteinmaradékok oldalláncaihoz, valamint prenilcsoportok (15 vagy 20 karbon) hozzáadását a karboxi-terminális ciszteinmaradékok oldalláncaihoz (lásd a 7.29, 7.30 és 7.31 ábrákat). Bizonyos esetekben ezek a fehérjék (amelyek közül sokan perifériás membránfehérjékként viselkednek) a plazmamembránra irányulnak a polipeptidlánc pozitív töltésű régiói, valamint a mellékelt lipidek által., Ezek a pozitív töltésű fehérjetartományok kölcsönhatásba léphetnek a foszfatidil-szerin negatív töltésű fejcsoportjaival a plazmamembrán citoszolos felületén. Érdemes megjegyezni, hogy sokan a fehérjék rögzíteni a belső utasítást a plazma membrán (beleértve a Src, illetve Ras fehérjék Ábra szemlélteti 12.10) játszanak fontos szerepet az adás, a jelek, a sejtfelszíni receptorok, hogy az intracelluláris célokat, amint azt a következő fejezetben.