1introduction
krónikus aktív Epstein-Barr vírusfertőzés (CAEBV) egy klinikai kifejezés, amelyet a Straus eredetileg az EBV krónikus vagy tartós fertőzésével kapcsolatos betegségként határoz meg., Javasolt kritériumok diagnosztizálására súlyos krónikus EBV fertőzés magában foglalja a következő: 1) a súlyos betegség, a >6 hónap alatt kezdődött, mint elsődleges EBV fertőzés társul súlyosan kóros EBV antitest titer ; (2) nagyobb mennyiségű EBV DNS vagy súlyosan kóros szintje EBV antitestek, például kimutatása EBV DNS szövetekben vagy perifériás vér által Southern blot hibridizáció; EBV-kódolt kis RNS-1-pozitív sejtek érintett szövetekben vagy perifériás vér, >102.,5 kópia EBV DNS/µg perifériás vér mononukleáris sejtek DNS-ének; és nagymértékben abnormális EBV antitestek (anti-VCA IgG titerek ≥5120 vagy anti-EA IgG titerek ≥640), és (3) nincs bizonyíték korábbi immunológiai rendellenességekre vagy más közelmúltbeli fertőzésre, amely megmagyarázná a megfigyelt állapotot.,4
Alapján a felhalmozott adatok, CAEBV a T-sejt vagy NK-sejt típus közelmúltban meghatározott szisztémás EBV+ poliklonális, – ott vagy gyakran monoklonális lymphoproliferatív betegség (LPD) jellemzi, a láz, állandó hepatitis, hepatosplenomegalia, illetve nyirokcsomó-duzzanat, ami azt mutatja, különböző mértékben a klinikai súlyossága attól függően, hogy az immunválasz a fogadó, mind az EBV vírusterhelés.5,6
CAEBV gyakran kíséri bőrelváltozások, mint például a súlyos szúnyogcsípés allergia és hydroa-vacciniforme (HV)-szerű T-sejt limfoproliferatív betegség., Szúnyogcsípés túlérzékenység (vagy szúnyogcsípés allergia, MBH) egy egyedi bőr megnyilvánulása CAEBV fertőzés jellemző a rendkívül intenzív helyi reakció ízeltlábú falatot terület kapcsolódó szisztémás tünetek: láz, nyirokcsomó-duzzanat, illetve májműködési zavar. Az EBV Genom elsősorban az mbH betegek perifériás vérének NK sejtjeiben található, akik gyakran NK sejtes limfocitózist mutatnak.,7-10
a HV-szerű LPD egy EBV-vel összefüggő poliklonális, oligoklonális vagy monoklonális bőr T-sejtes lymphoproliferatív betegség, amelyet visszatérő vesiculopapularis kitörések jellemeznek, elsősorban az arcon és a karokon. Ez azt mutatja, széles spektrumú klinikai agresszivitás, és általában egy hosszú klinikai lefolyású kockázata, hogy dolgozzon ki a szisztémás limfóma. A betegség előrehaladtával a betegeknél súlyos és kiterjedt bőrelváltozások alakulnak ki szisztémás tünetekkel, beleértve a lázat, hepatosplenomegaliát és lymphadenopathiát., A klasszikus HV, súlyos HV és HV-szerű T-sejtes lymphoma az EBV-vel összefüggő HV-szerű LPD kontinuum spektrumát képezi.5,11-14
a közelmúltban a fent említett három rendellenesség az EBV-vel összefüggő T-sejt és NK-sejtes LPD spektrumát reprezentálta különböző klinikai kiszerelésekkel; egy szisztémás és két bőrbetegség, beleértve a HV-szerű T-sejtes LPD-t és az MBH-t.14
2case jelentések
a következő két esettanulmányban leírt betegek a CAEBV MBH-val való tipikus klinikai megnyilvánulásait ábrázolják gyermekeknél. A 2. esetet korábban jelentették.15
2.,1Case 1
egy 15 éves koreai fiút 5 éves kora óta krónikus, időszakos bőrgyógyászati és különböző szisztémás tünetekkel és jelekkel szállítottak kórházba. A születési súly normális volt, és megfelelő volt a terhességi korhoz. Egy gyermekgyógyászati osztályon nemrégiben tett látogatása során megfelelő 163,7 cm magasságot mutatott korához, de alacsony testtömege 39,6 kg.
5 éves korában hirtelen láz, köhögés és haspuffadás alakult ki. A fehérvérsejtszám 12,1 × 103/µl volt (limfociták 70%, szegmentált neutrofilek 21%, eozinofilek 1%, monociták 8%)., A kvalitatív fluoreszcens antinukleáris antitest negatív volt. A bélperforáció klinikai diagnózisát követően subtotalis colectomián és ileostomián ment keresztül. Egy hónappal a műtét után a limfocita részhalmazok áramlási citometria szerint alacsony számú B – és T-sejtet mutattak, jelentősen megnövekedett NK-sejtekkel (CD16 + CD56+ = 68%, normál tartomány 5,6-31%); 1,579/µl (normál tartomány 100-430/µl).,
ezt követően 3 év alatt öt alkalommal került kórházba akut pharyngotonsillitis, felső légúti fertőzés, bronchiolitis és tüdőgyulladás miatt, és havonta két-három alkalommal visszatérő lázban szenvedett. 10 éves korában kórházba került a felső légúti fertőzés miatt. A 10,76 cm-es splenomegáliát egyébként a munka során találták meg. 10 éves kortól, intenzív bőrválaszok megnyilvánult szúnyog-vagy más bug-megharapott helyek, amelyek jellemzik a kezdeti bullous változás, majd fekély, kéreg kialakulását, és hegesedés pigmentáció (ábra. 1)., A legtöbb elváltozás
cm átmérőjű volt, és gyakran lázzal járt. Az ilyen bőrelváltozások általában nyáron, valamint a felső és alsó végtagokon fordultak elő. A súlyos szúnyogcsípés allergia idején végzett laboratóriumi vizsgálatok az aszpartát-transzamináz/alanin-transzamináz (AST/ALT) enyhe emelkedését mutatták, az alkalikus foszfatáz (200U/l) és a globin (4, 5-4, 8 g/dl) jelentős emelkedésével.
egy elváltozásból származó bőrbiopsziát jelentettek Sweet-szindróma lehetőségére utalásként. A hasi Szonográfia splenomegaliát mutatott., A perifériás vér differenciálszámai alacsony B – és T-sejtpopulációt, valamint NK-sejtes limfocitózist mutattak . A szérum IgE-szintet 20,370 U/ml-re emelték, bár nem azonosítottak specifikus választ a különböző allergén ingerekre. Annak ellenére, hogy nincs bizonyított családi anamnézis, a hyper-IgE szindróma klinikai benyomása az első differenciáldiagnózis volt. Egy olyan genetikai vizsgálatot végeztek, amely STAT3 szekvenálást tartalmazott, de nem sikerült megtalálni a várt mutációt., A klinikai lefolyást és az NK lymphocytosist figyelembe véve a CAEBV-vel vagy EBV-vel összefüggő lymphoproliferatív betegséget más differenciáldiagnózisnak tekintették, és releváns vizsgálatokat állapítottak meg.
a szerológiai vizsgálatok az EBV VCA-IgG, az EBV-korai antigén és az EBV VCA IgM negativitását mutatták. Teljes vérminta alkalmazásával valós idejű kvantitatív PCR-t végeztünk az EBV DNS-hez a vér vírusterhelésének meghatározására (11 450 kópia/5 µl teljes vér). Ezt követően rendszeresen ellenőrizte a vírusgenom másolási számát, amelyet következetesen magasnak találtak, 212-től kezdve.,5 kópia/µl-1562 kópia/µl teljes vér. A szúnyogokkal vagy bogarakkal kapcsolatos bőrproblémája azóta időszakosan fordult elő, míg a bőrelváltozástól mentes lázas betegség időszakos epizódjai szintén fennmaradtak. A nem specifikus bőrprobléma 15 hónapig fennmaradt. A fizikális vizsgálat során az erythemás-barnás pikkelyes foltok sárgás kéreggel jelentek meg az arcán, a nyakán, a fejbőrén, a mellkas felső részén és a hát felső részén. Helyi szteroidokkal és orális antihisztaminokkal kezelték, seborrheás dermatitisz hatására 11 hónapig (ábra. 1)., Két hónappal a vizsgálat előtt a tünetei súlyosbodtak, és ellátogatott egy dermatológiai klinikára. Az arcáról és a nyakáról két bőrbiopsziát vittek el, majd az EBV in situ hibridizációját végezték el. A biopsziák fokozott lymphoplasma sejteket mutattak a felületes és mély dermisben, alkalmanként periadnexalis eloszlással. A legtöbb limfoid sejtben nem volt egyértelmű atipia. Az immunhisztokémia számos CD56+ limfoid sejtet mutatott. Számos limfociták mutattak nukleáris pozitív reakciót az Eber in situ hibridizációra., Utólag, EBER in situ hibridizáció alkalmazták mind a bőr biopszia a lábszár venni a súlyos szúnyogcsípés allergia, a perforált bél vágnia 10 évvel ezelőtt (Fig. 2). Számos pozitív reakcióval rendelkező limfoid sejtet azonosítottak, nemcsak a bőrben, hanem a máj és a nyirokcsomó bélfalában és sinusoidjaiban is, amelyek megerősítették a caebv fertőzést szúnyogcsípés allergiával és NK lymphocytosissal. A beteget konzervatív módon kezelték. Két évvel később a hemophagocytic lymphohistiocytosis (HLH) miatt újrafogalmazták., A HLH-2004 kezelési útmutató szerint kezelték16 és átmenetileg reagált, de később bélperforációt váltott ki, és szepszisben halt meg.
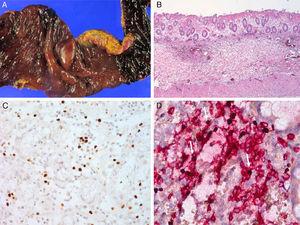
Case 1. A) perforált vastagbél 5 éves korban. B) a mikroszkopikus eredmények akut és krónikus gyulladást mutatnak granulációs szövetekkel. C) az Eber in situ hibridizáció EBV-pozitív limfocitákat tár fel. D) az EBV-pozitív limfociták pozitívak a CD3-ra.
2.,2Case 2
egy 10 éves koreai fiú bemutatta a dermatológiai osztálynak, amely a szúnyogcsípés helyén intenzív bőrreakciókra panaszkodott. Többszörös szétszórt, szakított fekélyeket mutatott a kétoldalú alsó végtagokon. Amellett, hogy a jelölt bőrreakció, ő is támogatta a szisztémás tünetek, beleértve a láz követő rovarcsípés egész gyermekkorában. Bőrbiopsziát végeztek, és a lézió helyi kezelését további szisztémás értékelés nélkül alkalmazták. 16 éves korában a beteg 2-3 hetes időtartamú, a bal nyakán található tapintható masszával fogadta be., A fizikai vizsgálat során nagy nyirokcsomók konglomerátuma volt jelen a bal nyakban,amelyek közül a legnagyobb 7 × 5 cm-es volt. A bőrelváltozások története miatt a lábait alaposan megvizsgálták, többszörös sekély fekélyeket fedeztek fel gyógyító hegekkel. A komputertomográfia és a pozitron emissziós tomográfia vizsgálata több, rosszul növelő és változó méretű, homogén nyirokcsomót mutatott, amelyek a bal nyaki és a kétoldali inguinalis területeket érintették., Emellett multifokális elváltozások is voltak, amelyek a kétoldali arc és fenék bőrén és bőr alatti rétegében fokozott 2-deoxi-2 – fluoro-D-glükóz felvételre utaltak. Hematológiai vizsgálat során a vérsejtszám és a tejsav-dehidrogenáz szint a normál határértékeken belül volt. Az Anti – VCA IgG, anti-EA és anti-EBNA IgG pozitív és anti – VCA IgM negatív volt. Az EBV DNS-másolat száma 529,8 kópia/µl volt a teljes vérből.,
nyirokcsomó-biopsziát végeztek, amely a paracortex kiszélesedését mutatta heterogén gyulladásos sejtek, köztük kis limfociták, histiociták és sok eozinofil infiltrációjával. A gyulladásos infiltrációt szétszórt nagy mononukleáris vagy multinukleáris Reed-Sternberg (RS)-szerű atipikus sejtek szakították meg, amelyek nagy eozinofil nukleolokkal és vastag nukleáris membránnal rendelkeztek., Immunhisztokémiai vizsgálattal az RS-szerű sejtek erős hártyás foltot mutattak a CD30 és perinukleáris festéshez a CD15 esetében, és pozitívak voltak a PAX-5 és az LMP-1 esetében, de negatívak voltak a CD20, CD3 és EBNA-2 esetében. Az atipikus mononukleáris és multinukleáris RS-szerű sejtek pozitív jelet mutattak az Eber in situ hibridizációjával. Az RS-szerű sejteken kívül a háttérben szétszórt sok kis limfociták is pozitívak voltak az Eber in situ hibridizációjára. A csontvelő biopsziában nem észleltek abnormális eredményeket, kivéve néhány EBV-pozitív kis limfocitát., 2002-ben visszamenőlegesen megvizsgálták a szúnyogcsípés-allergia területéről származó bőrbiopsziát, feltárva az epidermisz és a felső dermis súlyos nekrózisát. Ott volt beszivárgás kis limfociták, histiocytes sok eosinophil körül az erek, s hajhagymákat a véredény lumen gyakran olvashatatlanná vörösvértestek (Vvt), valamint a fibrin. Immunhisztokémiai elemzés kimutatta, hogy az infiltráló sejtek heterogének voltak a származásukban; egyesek pozitívak voltak a CD3 és CD4 vagy CD8 helper vagy citotoxikus T sejtekre, míg mások a CD56-ra pozitív NK sejtek voltak., Számos EBV-pozitív sejtet dokumentált az Eber in situ hibridizáció. A Hodgkin-limfómát szimuláló, krónikus aktív EBV-fertőzés szúnyogcsípés túlérzékenységgel és polimorf limfoproliferációval történő diagnosztizálása megtörtént. A beteget ABVD-vel (adriamicin, bleomicin, vinblasztin és dakarbazin) kezelték hat ciklus alatt, teljes remisszióval. Jelenleg a kezelés után 7 évig mentes a betegségtől.,
3DISCUSSION
A CAEBV-betegek klinikai lefolyása az EBV-vel összefüggő tényezők és a gazdaszervezet immunfunkció közötti egyensúlytól függ, és lehet parázsló, progresszív vagy agresszív. Egyes betegeknél EBV+ t / NK sejtes limfóma / leukémia alakul ki.1998 és 2014 között 13 10-58 éves (medián életkor 22 év, kilenc férfi és négy nő) beteget diagnosztizáltak CAEBV-betegséggel a koreai Samsung Medical Centerben (1.táblázat). A gyakori klinikai eredmények közé tartozott a láz (13/13), a hepatosplenomegalia (9/12), a lymphadenopathia (7/11), az NK lymphocytosis (3/4), az MBH (4/13) és a HV-szerű LPD (2/13)., Néhány betegnél bélperforáció, chorea vagy agyi infarktus lépett fel. A 36 hónapos medián követés során hét beteg (54%) halt meg a betegségben, két beteg (15%) tartós betegségben szenvedett, és két beteg (17%) mentes volt a betegségtől. Két beteg elvesztette a nyomon követést. A halál oka négy beteg hemofagocitikus szindrómája és szervi elégtelensége, egy beteg EBV-pozitív T-sejtes limfómája, egy beteg agresszív NK-sejtes leukémiája volt. A Hodgkin-limfómát utánzó B-lineage limfoproliferáció a 2. esetnek megfelelően ritka, de korábban beszámoltak róla.,18
CAEBV fertőzés szinte mindig kíséri különböző fokú limfoproliferáció. Az EBV-vel és EBV – vel fertőzött T-vagy NK-sejtek klonalitása változó lehet poliklonális, oligoklonális vagy monoklonális. Mivel a betegség a poliklonális limfoproliferációtól a monoklonális betegségig terjed, a szövettani atypia nő. Ohshima et al. javasolt a CAEBV csoportosítása három csoportba—polimorf és poliklonális, polimorf és monoklonális, vagy monomorf és monoklonális-klonalitás és szövettani változások alapján.19 a sorozat által jelentett Ohshima et al., A CAEBV-fertőzésben szenvedő 8/48 beteg poliklonális volt a TCR gén átrendeződése szempontjából, és az infiltrált sejtek polimorf hisztomorfológiát mutattak; 15 beteg polimorf morfológiát, valamint biclonális vagy monoklonális TCR gén átrendeződést mutatott; 25 beteg monomorf szövettani és monoklonális TCR gén átrendeződést mutatott. A CAEBV-fertőzés monomorf és monoklonális típusában szenvedő betegeknél gyengébb prognózisok voltak, mint a polimorf poliklonális vagy polimorf monoklonális betegségben szenvedőknél. A polimorf / poliklonális és polimorf / monoklonális csoportok túlélése nem különbözött szignifikánsan., CAEBV monomorf / monoklonális csoportjai Ohshima et al. megfelelhet a szisztémás T-sejtes LPD-nek a 2008.évi WHO osztályozás szerint.20
összefoglalva, a CAEBV egy ritka EBV-vel összefüggő LPD, túlnyomórészt T-sejtes vagy NK-sejtes vonalból, a klinikai megjelenés széles spektrumával. A betegség felismerése fontos a beteg megfelelő kezeléséhez. EBV analízis valós idejű PCR vérminta vagy EBV in situ hibridizáció az érintett szövetben fontos, hogy ne néző ezeket a betegeket, és be kell vonni a fő diagnosztikai vizsgálatok lázas gyermekek.,
etikai közzététel
emberi és állati alanyok védelme. A szerzők kijelentik, hogy a vizsgálathoz nem végeztek kísérleteket embereken vagy állatokon.
adatok bizalmas kezelése. A szerzők kijelentik, hogy a betegadatok közzétételével követték munkaközpontjuk protokolljait.
a magánélethez való jog és a beleegyezés joga. A szerzők kijelentik, hogy ebben a cikkben nem jelennek meg betegadatok.
összeférhetetlenség
a szerzők semmilyen jellegű összeférhetetlenséget nem állapítanak meg.