hosszú válasz. Először is különbséget kell tenni egy kötés polaritása és egy molekula (vagy vegyület) polaritása között.
a kötés polaritása az elektromos töltés elválasztására utal, amely az elektronegativitás különbségéből származik a két egymással összekapcsolódó atom vagy csoport között.,
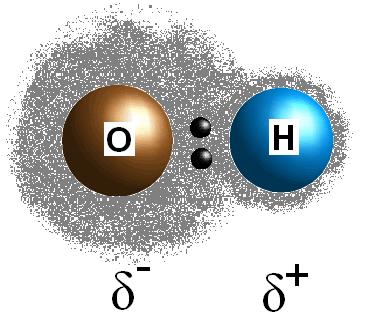
Ez az elektronegativitási értékbeli különbség a két atom között egyenlőtlenül osztja meg a kötés elektronjait, így a kevésbé elektronegatív atomon (#delta^+#), a több elektronegatív atomon pedig részleges negatív töltést (#delta^(-)#) hoz létre. A kötés polaritása kizárólag a két alkotó Atom elektronegativitási értékeivel határozható meg.
Ha a két atom közötti kötés nem poláris, azaz a két atom közötti Elektronegativitás különbsége kevesebb, mint 0.,5, akkor a molekula nem poláris lesz. Ha a kötés valóban poláris, akkor megpróbálhatja meghatározni a molekula polaritását.
egy molekula geometriája fontos tényező egy molekula polaritásának meghatározásában. Ezek a fent említett részleges díjak bond dipólus pillanatot eredményeznek, #mu#.
ha ezeknek a kötési dipól pillanatoknak az orientációja megszünteti egymást, akkor azt mondják, hogy a molekula nem poláris. Ha azonban nem, akkor van dolgunk egy poláris molekula.,
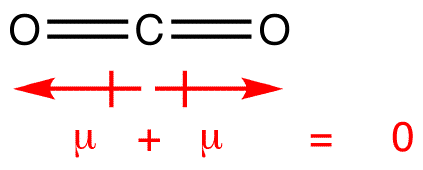
Dipól pillanatok állítják, hogy a nyíl mutat a több electronegative atom, meg a plusz oldalon a kevésbé electronegative atom. Figyeljük meg, hogy a #CO_2#, amelynek két poláris kötése van, a teljes dipólus pillanat nulla, mivel ez a két nyíl megszünteti egymást. Ez nem poláris molekulát eredményez., Ugyanez mondható el a #BF_3#:
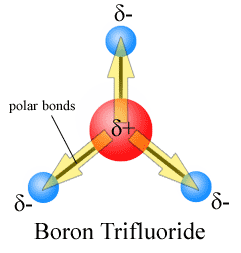
A három dipólus pillanat megszakítja egymást a kötések szimmetrikus elrendezésének eredményeként (Lásd még a vektor hozzáadását).
a részleges töltések asszimetrikus elrendezése poláris molekulát eredményez, amint az a víz esetében látható:
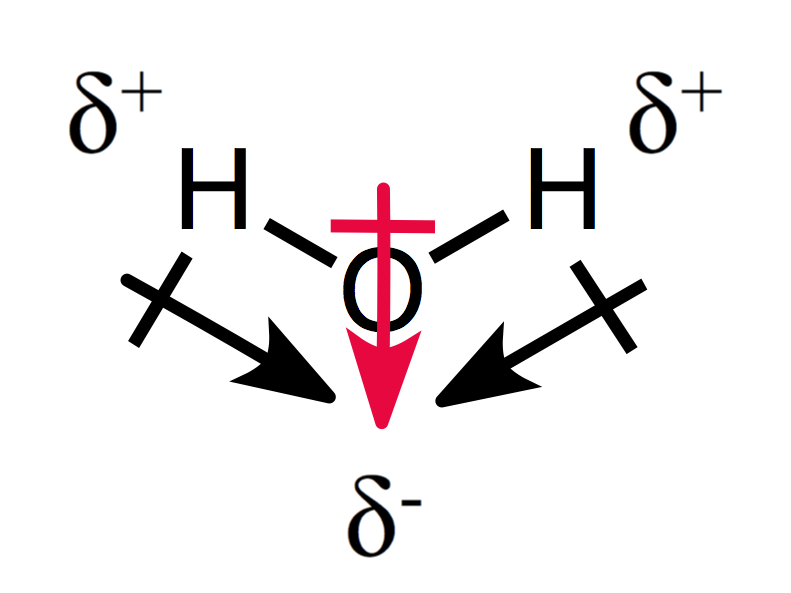
a két dipól pillanat egymáshoz ad egy teljes dipólus pillanatot, így egy poláris molekulát.,
következtetésként egy molekula polaritásának előrejelzéséhez ismernie kell a Lewis-struktúrákat, az elektronegativitást, a VSEPR-elméletet és a kötés polaritását.