tanulási célok
e szakasz végére képes lesz:
- leírni, hogyan fedezték fel az elektronokat.
- magyarázza el a Millikan olajcseppkísérletet.
- írja le Rutherford aranyfólia kísérletét.
- írja le Rutherfordnak az atom bolygómodelljét.
ugyanúgy, ahogy az atomok az anyag szubsztrátjai, az elektronok és a magok az atom szubsztrátjai., Az elektronok és atommagok felfedezésére használt kísérletek feltárják az atomok néhány alapvető tulajdonságát, és könnyen megérthetők olyan ötletekkel, mint az elektrosztatikus és a mágneses erő, amelyeket már az előző fejezetek tárgyaltak.
töltések és elektromágneses erők
korábbi megbeszéléseink során megállapítottuk, hogy a pozitív töltés atommagokkal és negatív töltéssel van összefüggésben az elektronokkal. A töltéseket befolyásoló elektromos és mágneses erők számos aspektusát is lefedtük., Most megvizsgáljuk az elektron és a mag felfedezését, mint az atom alépítményeit, és megvizsgáljuk az atomok tulajdonságaihoz való hozzájárulásukat.
az elektron

1.ábra. Egy gázkisüléses cső világít, amikor nagy feszültséget alkalmaznak rá. A katódból kibocsátott elektronok felgyorsulnak az anód felé; gerjesztik a gázban lévő atomokat és molekulákat, amelyek válaszul ragyognak., Az egykor Geissler-csöveknek, majd később Crookes-csöveknek nevezett katódsugárcsövek (CRTs) néven ismertek, és régebbi tévékben, számítógépes képernyőkben és röntgengépekben is megtalálhatók. Mágneses mező alkalmazása esetén a gerenda a negatív töltés várható irányában hajlik. (hitel: Paul Downey, Flickr)
gázkisüléses csövek, mint például az 1.ábrán látható, két fémelektródát és egy ritka gázt tartalmazó evakuált üvegcsőből állnak. Ha nagy feszültséget alkalmaznak az elektródákra, a gáz világít. Ezek a csövek voltak a mai neonfények előfutárai., Ők voltak az első tanult komolyan Heinrich Geissler, egy német feltaláló akaratát, kezdve az 1860-as években. Az angol tudós, William Crookes, többek között, folyamatosan tanulmányozza, amit egy ideje hívták Crookes-cső, melyben az elektronok megszabadult atomok illetve molekulák a ritkított gáz a cső belsejében, illetve a gyorsított a katód (negatív), hogy az anód (pozitív) által rejlő nagy lehetőségeket., Ezek a “katód sugarak” ütköznek a gáz atomok illetve molekulák gerjeszti őket, így a kibocsátott elektromágneses (EM) sugárzás, ami az elektronok pályáját láthatóvá ray terjed, eltűnik, mint távolodik a katód.
a gázkisüléses csöveket manapság leggyakrabban katódsugárcsöveknek nevezik, mivel a sugarak a katódból származnak. A Crookes azt mutatta, hogy az elektronok lendületet hordoznak (egy kis lapátkereket forgathatnak)., Azt is megállapította,hogy általában egyenes útjukat egy mágnes hajlítja a katódtól távolodó negatív töltés irányába. Ezek voltak az elektronok és töltésük első közvetlen jelzései.

2. J. J. Thomson (egyértelműsítő lap www.firstworldwar.com, via Wikimedia Commons)
az angol fizikus J. J. Thomson (1856-1940) javította és bővítette a kísérletek körét gázkisüléses csövekkel. (Lásd a 2. ábrát és a 3.ábrát.,) Ellenőrizte a katódsugarak negatív töltését mind mágneses, mind elektromos mezőkkel. Ezenkívül összegyűjtötte a sugarakat egy fém pohárba,és negatív töltést talált. Thomson képes volt mérni az elektron töltésének arányát a tömegéhez képest, \frac{q_e}{m_e} \ \ – fontos lépés mind a qe, mind én tényleges értékeinek megtalálásához. A 4. ábra egy katódsugárcsövet mutat, amely keskeny elektronsugarat hoz létre, amely áthalad a nagyfeszültségű tápegységhez csatlakoztatott töltőlemezeken., A töltőlapok között elektromos e mező keletkezik, a katódsugárcsövet pedig egy mágnes pólusai közé helyezzük úgy, hogy az e elektromos mező merőleges legyen a mágnes B mágneses mezőjére. Ezek a mezők, amelyek merőlegesek egymásra, ellentétes erőket hoznak létre az elektronokon. Amint azt a tömegspektrométerek esetében a mágnesesség több alkalmazásában tárgyaltuk, ha a mezők miatt a nettó erő eltűnik, akkor a töltött részecske sebessége v=\frac{E}{B}\\., Ilyen módon Thomson meghatározta az elektronok sebességét, majd az elektromos mező beállításával felfelé és lefelé mozgatta a gerendát.

3.ábra. Thomson CRT diagramja. (hitel: Kurzon, Wikimedia Commons)

4.ábra. Ez a vázlat mutatja az elektronsugarat egy CRT-ben, amely áthalad a keresztezett elektromos és mágneses mezőkön, és a foszfor fényét okozza, amikor a cső végére ér.
gyűjtési Feltételek, van \ frac{q_e}{m_e} = \ frac{a}{e}\.,
mi olyan fontos a \frac{q_e}{m_e}\\ – ban, az elektron töltésének aránya a tömegéhez? A kapott érték
\displaystyle\frac{q_e}{m_e}=-1,76\times10^{11}\text{ C/kg (electron)}\\
Ez egy hatalmas szám, ahogy Thomson rájött, és ez azt jelenti, hogy az elektronnak nagyon kis tömege van. A galvanizálásból ismert volt, hogy körülbelül 108 C/kg szükséges egy anyag lemezéhez, ami körülbelül 1000-rel kevesebb, mint az elektronok kilogrammonkénti töltése., Thomson folytatta ugyanezt a kísérletet a pozitív töltésű hidrogénionok (ma már ismert, hogy csupasz protonok) esetében, és kilogrammonként körülbelül 1000-szer kisebb töltést talált, mint az elektron esetében, ami azt jelenti, hogy a proton körülbelül 1000-szer nagyobb tömegű, mint az elektron. Ma már pontosabban tudjuk, hogy
\displaystyle\frac{q_p}{m_p}=9,58\times10^{7}\text{ C/kg (proton)}\\,
ahol a QP a proton és az mp töltése a tömege. Ez az arány (négy jelentős számra) 1836-szor kevesebb töltés kilogrammonként, mint az elektron esetében., Mivel az elektronok és protonok töltése egyenlő nagyságrendű, ez mp = 1836me értéket jelent.
Thomson különböző kísérleteket végzett különböző gázokkal a kisülési csövekben, és más módszereket alkalmazott, például a fotoelektromos hatást, az elektronok atomoktól való felszabadítására. Mindig ugyanazokat a tulajdonságokat találta az elektron számára, bizonyítva, hogy független részecske. Munkájáért, amelynek fontos darabjait 1897-ben kezdte publikálni, Thomson elnyerte az 1906-os fizikai Nobel-díjat., Visszatekintve nehéz megérteni, milyen megdöbbentő volt megtalálni, hogy az atomnak van egy alszerkezete. Maga Thomson azt mondta: “csak akkor voltam meggyőződve arról, hogy a kísérlet nem hagyott menekülni tőle, hogy közzétettem a hitemet az atomoknál kisebb testek létezésében.”
Thomson megpróbálta megmérni az egyes elektronok töltését, de módszere csak a várt nagyságrendig tudta meghatározni a töltését.
Faraday az 1830-as években galvanizálással végzett kísérletei óta ismert volt, hogy molonként körülbelül 100 000 C-ra volt szükség az ionizált ionok külön-külön történő lemeztételéhez., Ezt elosztva a molonkénti ionok számával (azaz Avogadro számával), amely megközelítőleg ismert volt, az iononkénti töltést körülbelül 1,6 × 10-19 C-ra számítottuk, közel a tényleges értékhez.

5.ábra. Robert Millikan (hitel: Ismeretlen Szerző keresztül Wikimedia Commons)
Egy Amerikai fizikus, Robert Millikan (1868-1953) (Ábra 5), úgy döntött, hogy javítsa a Thomson kísérlet mérési qe, s végül arra kényszerültek, hogy megpróbál egy másik megközelítés, amely most egy klasszikus kísérlet által végzett diákok., A Millikan olaj csepp kísérlet ábrán látható 6.
A Millikan olajcseppkísérletben finom csepp olajat permeteznek egy porlasztóból. Ezek közül néhányat a folyamat tölt fel, majd a lemezek közötti feszültséggel felfüggeszthető a fémlemezek között. Ebben a helyzetben a csepp súlyát kiegyensúlyozza az elektromos erő:
m dropg = qe E

6.ábra., A Millikan olajcseppkísérlet az elektronok töltésének első pontos közvetlen mérését eredményezte, amely a természet egyik legalapvetőbb állandója. A permetezés során finom csepp olaj kerül felszámolásra. Mozgásuk megfigyelhető a fémlemezek között, amelyek potenciállal rendelkeznek a gravitációs erő ellen. A gravitációs és elektromos erők egyensúlya lehetővé teszi a töltés cseppenkénti kiszámítását. A töltést -1,6 × 10-19 C egységekben kvantálják, így közvetlenül meghatározzák az olajcseppek felesleges és hiányzó elektronjainak töltését.,
az elektromos mezőt az alkalmazott feszültség állítja elő, ezért E=\frac{v}{d}\\, A V pedig úgy van beállítva, hogy csak kiegyenlítse a csepp súlyát. A cseppek mikroszkóppal visszavert fénypontoknak tekinthetők, de túl kicsik ahhoz, hogy közvetlenül mérjék méretüket és tömegüket. A csepp tömegét úgy határozzák meg, hogy megfigyelik, milyen gyorsan esik le, amikor a feszültség ki van kapcsolva. Mivel ezeknek a szubmikroszkópos cseppeknek a légellenállása nagyon jelentős, a masszívabb cseppek gyorsabban esnek, mint a kevésbé masszív, a kifinomult ülepedési számítások feltárhatják tömegüket., Az olajat víz helyett használják, mert nem párolog el könnyen, így a tömeg majdnem állandó. Miután a csepp tömege ismert, az elektron töltését az előző egyenlet átrendezésével adjuk meg:
\displaystyle{q} = \ frac{m_ {\text {drop}}} g}{e}=\frac{M_{\text {drop}}GD}{V}\,
ahol d a lemezek elválasztása és V az a feszültség, amely a cseppmozgást tartja. (Ugyanaz a csepp több órán keresztül megfigyelhető, hogy valóban mozdulatlan.,) 1913-ra Millikan az elektron qe töltését 1% – os pontossággal mérte, és ezt néhány éven belül 10-es tényezővel javította -1, 60 × 10-19 C értékre. A qe ezen alapvető közvetlen méréséért és a fotoelektromos hatás tanulmányozásáért Millikan elnyerte az 1923-as fizikai Nobel-díjat.,
az ismert elektron töltésével és az ismert töltés-tömeg aránnyal kiszámítható az elektron tömege. Ez
\displaystyle{m}=\frac{q_e}{\left(\frac{q_e}{m_e}\right)}\\
Helyettesítő ismert értékek hozamok
\displaystyle{m}_e=\frac{-1.60\times10^{-19}\text{ C}}{-1.76\times10^{11}\text{ C/kg}}\\
vagy nekem = 9.11 × 10-31 kg (elektron tömege), ahol a kerekítési hibák kijavításra kerültek., Az elektron tömegét számos későbbi kísérletben ellenőrizték, és ma már ismert, hogy egy millió résznél jobb pontosságú. Ez egy hihetetlenül kis tömegű marad a legkisebb ismert tömege bármely részecske, amelynek tömege. (Egyes részecskék, mint például a fotonok, tömegtelenek, és nem nyugszanak, hanem fénysebességgel közlekednek.) Hasonló számítás más részecskék tömegét adja, beleértve a protont is. Három számjegyig a proton tömege ma ismert mp = 1, 67 × 10-27 kg (proton tömege), amely közel azonos a hidrogénatom tömegével., Thomson és Millikan célja az volt, hogy bebizonyítsák az atomok egy alszerkezetének, az elektronnak a létezését, továbbá hogy megmutassák, hogy az atom tömegének csak egy apró töredéke van. Az atom magja tömegének nagy részét tartalmazza, a mag jellege pedig teljesen váratlan volt.
a kvantummechanika másik fontos jellemzője is kezdett megjelenni. Minden elektron azonos egymással. Az elektronok töltése és tömege nem átlagérték, hanem egyedi értékek, amelyek minden elektronnak vannak., Ez igaz más szubmikroszkópos szintű alapvető entitásokra is. Minden proton azonos egymással, stb.
A Nucleus
itt megvizsgáljuk a mag méretének és tömegének első közvetlen bizonyítékait. A későbbi fejezetekben a nukleáris fizika számos más aspektusát vizsgáljuk, de a nukleáris méretre és tömegre vonatkozó alapvető információk annyira fontosak ahhoz, hogy megértsük az atomot, amelyet itt tekintünk.
A nukleáris radioaktivitást 1896-ban fedezték fel, és hamarosan a világ számos legjobb tudósának intenzív tanulmánya tárgyává vált., Köztük volt az Új-zélandi Lord Ernest Rutherford, aki számos alapvető felfedezést tett, és elnyerte a “nukleáris fizika atyja” címet.”Nelson-ban született Rutherford posztgraduális tanulmányait az angliai Cavendish laboratóriumokban végezte, mielőtt a kanadai McGill Egyetemen helyezkedett el, ahol 1908-ban kémiai Nobel-díjat kapott. Az Atomfizika és az Atomfizika területén nagy az átfedés a kémia és a fizika között, a fizika biztosítja az alapvető elméleteket., A későbbi években visszatért Angliába, és hat jövőbeli Nobel-díjas tanítványa volt. Rutherford nukleáris sugárzást használt az atommag méretének és tömegének közvetlen vizsgálatára. Az általa kidolgozott kísérletet a 7. ábra mutatja. Az alfa-sugárzást kibocsátó radioaktív forrást egy ólomtartályba helyeztük, amelynek egyik oldalán lyuk volt, hogy alfa-részecskéket állítsunk elő, amelyek egyfajta ionizáló sugárzás, amelyet egy radioaktív forrás magjai bocsátanak ki., A fénysugárba vékony aranyfóliát helyeztek, az alfa-részecskék szétszóródását pedig az okozta fény, amelyet a foszforszűrő megütésekor okoztak.

5.ábra. Rutherford kísérlete közvetlen bizonyítékot szolgáltatott a mag méretére és tömegére azáltal, hogy alfa-részecskéket szétszórt egy vékony aranyfóliából. 5mev energiájú alfa-részecskéket bocsátanak ki egy radioaktív forrásból (amely egy kis fémtartály, amelyben egy bizonyos mennyiségű radioaktív anyag van lezárva), egy gerendába ütköznek, és a fóliára esnek., A fóliába behatoló vagy különböző szögekre szóródó részecskék száma azt jelzi, hogy az aranymagok nagyon kicsiek, és az aranyatom tömegének csaknem az egészét tartalmazzák. Ezt különösen az alfa-részecskék jelzik, amelyek nagyon nagy szögekre szétszóródnak, hasonlóan a kapus fejéről pattogó futballlabdához.,
Alfa-részecskék voltak ismert, hogy a kétszeresen pozitív töltésű atommagok hélium atomok volt kinetikus energiák a megbízás 5 MeV, amikor kibocsátott nukleáris pusztulás, amely a szétesés, az atommag instabil nuclide a spontán emisszió a töltött részecskék. Ezek a részecskék elsősorban a Coulomb-erő hatására lépnek kölcsönhatásba az anyaggal, és az atommagokból való szétszóródás módja felfedheti a nukleáris méretet és tömeget. Ez hasonló ahhoz, hogy megfigyeljük, hogy egy bowling golyó szétszóródik egy olyan tárgy által, amelyet nem láthat közvetlenül., Mert az alfa-részecske energiája olyan nagy, összehasonlítva a tipikus energiák kapcsolódó atomok (MeV ellen eV), várható volt, hogy az alfa-részecskék egyszerűen összeomlik keresztül egy vékony fólia, mint egy szuperszonikus bowling golyó ütközés révén néhány tucat sor tekebábut. Thomson elképzelte, hogy az atom egy kis gömb, amelyben egyenlő mennyiségű pozitív és negatív töltés egyenletesen oszlik el. Az incidens hatalmas alfa-részecskék csak kis eltéréseket szenvednének egy ilyen modellben., Ehelyett Rutherford és munkatársai azt találták, hogy az alfa-részecskék időnként nagy szögekre szétszóródtak, néhányan még vissza is térnek abba az irányba, ahonnan jöttek! Részletes elemzés segítségével megőrzése lendület és energia-különösen a kis számú, hogy jött egyenesen vissza-azt sugallta, hogy az arany magok nagyon kicsi, mint a méret egy arany atom, tartalmazza szinte az összes atom tömege, és szorosan kötődik. Mivel az Aranymag többszörösen masszívabb, mint az alfa-részecske, egy frontális ütközés az alfa-részecskét egyenesen a forrás felé szétszórja., Ezenkívül minél kisebb a mag, annál kevesebb alfa-részecske van, amely egy fejre ütközik.
bár a kísérlet eredményeit kollégái 1909-ben tették közzé, Rutherfordnak két évbe telt, hogy meggyőzze magát a jelentéséről. Mint Thomson előtte, Rutherford vonakodott elfogadni az ilyen radikális eredményeket. A természet kis léptékben annyira különbözik a klasszikus világunktól, hogy még a felfedezés élvonalában lévők is néha meglepődnek. Rutherford később ezt írta: “majdnem olyan hihetetlen volt, mintha egy 15 hüvelykes héjat lőtt volna egy darab papírzsebre, majd visszajött és megütött volna., Figyelembe véve, rájöttem ,hogy ez a szétszóródás visszafelé. . . . . . az atom tömegének legnagyobb része egy apró magban koncentrálódott.”
1911-ben Rutherford közzétette elemzését az atom javasolt modelljével együtt. A mag méretét úgy határoztuk meg, hogy körülbelül 10-15 m, vagy 100 000-szer kisebb, mint az atom. Ez hatalmas sűrűséget jelent, 1015 g/cm3 sorrendben, nagymértékben ellentétben a makroszkopikus anyagokkal. Szintén feltételezhető a korábban ismeretlen nukleáris erők létezése, hogy ellensúlyozzák a hatalmas visszataszító Coulomb erőket a mag pozitív töltései között., A hatalmas erők összhangban lennének a nukleáris sugárzásban kibocsátott nagy energiákkal is.

8.ábra. Az aranyfólia atomjainak kibővített nézete Rutherford kísérletében. A körök az atomokat képviselik (körülbelül 10-10 m átmérőjű), míg a pontok a magokat képviselik (körülbelül 10-15 m átmérőjű). Ahhoz, hogy látható legyen, a pontok sokkal nagyobbak, mint a skála. A legtöbb alfa-részecske összeomlik, de nagy energiájuk és az elektron kis tömege miatt viszonylag érintetlenek., Néhányan azonban egyenesen a mag felé tartanak, és egyenesen hátra vannak szétszórva. A részletes elemzés megadja a mag méretét és tömegét.
a mag kis mérete azt is jelenti, hogy az atom többnyire üres. Valójában Rutherford kísérletében a legtöbb alfa egyenesen az aranyfólián ment keresztül, nagyon kevés szórással, mivel az elektronok ilyen kis tömegűek, és mivel az atom többnyire üres volt, az alfa számára semmi sem érte el., Rutherford kísérleteinek idején már erre utaltak, mivel az energikus elektronokat megfigyelték, hogy a vártnál könnyebben behatolnak a vékony fóliákba. A 8. ábra az atomok vázlatát mutatja egy vékony fóliában, körökkel, amelyek az atomok méretét képviselik (körülbelül 10-10 m), valamint a magokat ábrázoló pontok. (A pontok nem skálázhatók—ha lennének, mikroszkópra lenne szükség ahhoz, hogy láthassa őket.) A legtöbb alfa-részecske hiányzik a kis magokból, és csak kis mértékben szétszóródnak az elektronok., Időnként (Rutherford kísérletében körülbelül 8000 – szer) egy alfa frontálisan eltalálja az atommagot,és egyenesen hátrafelé szóródik.

9.ábra. Rutherford az atom bolygómodellje magában foglalja a mag, az elektronok jellemzőit és az atom méretét. Ez a modell volt az első, aki felismerte az atomok szerkezetét, amelyben az alacsony tömegű elektronok nagyon kicsi, masszív magot keringenek a magnál sokkal nagyobb pályákon. Az atom többnyire üres, és hasonló a bolygórendszerünkhöz.,
a kísérlete által feltárt mag mérete és tömege, valamint az elektronok tömege alapján Rutherford javasolta az atom bolygómodelljét. Az atom bolygómodellje alacsony tömegű elektronokat ábrázol, amelyek egy nagy tömegű mag körül keringenek. Az elektron pályáinak mérete nagy a mag méretéhez képest, többnyire vákuum az atom belsejében. Ez a kép analóg azzal, hogy naprendszerünkben az alacsony tömegű bolygók a nagy tömegű napot nagy távolságra keringik a nap méretéhez képest., Az atomban a vonzó Coulomb erő hasonló a bolygórendszer gravitációjához. (Lásd A 9. Ábrát.) Vegye figyelembe, hogy a kísérleti eredmények magyarázatához modellre vagy mentális képre van szükség, mivel az atom túl kicsi ahhoz, hogy látható fényben közvetlenül megfigyelhető legyen.
Rutherford az atom bolygómodellje döntő fontosságú volt az atomok jellemzőinek, kölcsönhatásainak és energiáinak megértéséhez, amint azt a következő néhány szakaszban látni fogjuk. Azt is jelezte, hogy mennyire különbözik a természet az ismerős klasszikus világtól a kis, kvantummechanikai skálán., Az atomok és molekulák formájában az összes anyag számára egy szubsztrátum felfedezését most egy lépéssel tovább vitték, hogy felfedezzék az atomok szubsztrátját, amely egyszerűbb volt, mint az akkor ismert 92 elem. Folytattuk a mélyebb alépítmények keresését, mint például a mag belsejében, némi sikerrel. A későbbi fejezetekben ezt a küldetést követjük a kvarkok és más elemi részecskék megbeszélése során, és megvizsgáljuk, hogy a keresés milyen irányba halad.,
PhET Explorations: Rutherford Scattering
hogyan találta ki Rutherford az atom szerkezetét anélkül, hogy láthatta volna? Szimulálja a híres kísérletet, amelyben megcáfolta az atom szilva puding modelljét azáltal, hogy megfigyelte az atomokról pattogó alfa-részecskéket, és megállapította, hogy kicsi maggal kell rendelkezniük.
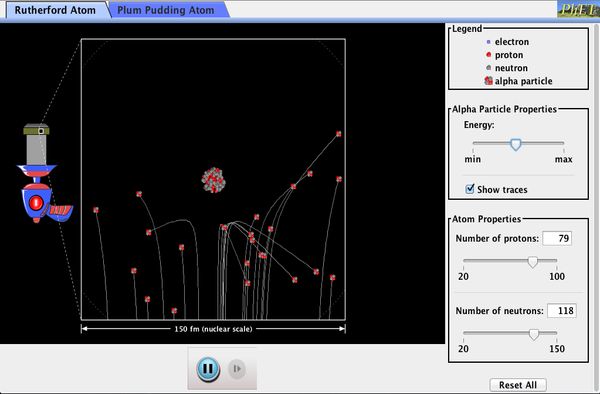
kattintson a szimuláció letöltéséhez. Futtatás Java használatával.,
szakasz összefoglaló
problémák & gyakorlatok
- Rutherford úgy találta, hogy a mag mérete körülbelül 10-15 m. ez hatalmas sűrűséget jelentett. Mi lenne ez a sűrűség az Arany számára?
- Millikan olajcseppkísérletében egy kis olajcseppet nézünk, amelyet két lemez között mozdulatlanul tartanak. Vegye ki a lemezek közötti feszültséget 2033 V-ra, a lemez elválasztása pedig 2,00 cm-re. Az olajcsepp (sűrűsége 0,81 g / cm3) átmérője 4,0 × 10-6 m. keresse meg a töltést a cseppen, az elektronegységek szempontjából.,
- (a) egy törekvő fizikus egy hidrogénatom skálamodelljét akarja felépíteni a science fair projektjéhez. Ha az atom 1,00 m átmérőjű, mekkora legyen a mag? b) milyen könnyű lesz ez?