a titrálás olyan térfogati technika, amelyben egy reagens (a mérőoldat) oldatát egy második reagens (az “analit”) oldatához addig adják, amíg el nem éri az egyenértékűségi pontot. Az ekvivalenciapont az a pont, ahol a titrálót pontosan a megfelelő mennyiségben adták hozzá, hogy sztoichiometrikusan reagáljanak az analitennel (amikor a titráns móljai = a vizsgált mólok). Ha a mérőoldat vagy az analit színezett, akkor az egyenértékűségi pont a szín eltűnése miatt nyilvánvaló, mivel a reagensek elfogynak., Ellenkező esetben olyan mutatót lehet hozzáadni, amelynek “végpontja” (színe megváltozik) az egyenértékűségi ponton, vagy az egyenértékűségi pont meghatározható egy titrálási görbéből. A hozzáadott titráns mennyiségét a koncentrációjából és térfogatából kell meghatározni:
n (mol) = C (mol/L) * V (L)
és a mérőoldat mennyisége felhasználható a szokásos sztöchiometrikus számításban a vizsgált anyag mennyiségének meghatározásához.
a titrálási folyamat az alábbi videóban figyelhető meg.,
a titrálandó oldat mért térfogata, ebben az esetben színtelen vizes ecetsav, CH3COOH(AQ) kerül egy főzőpohárba. A színtelen nátrium-hidroxid NaOH(AQ), amely a mérőoldat, óvatosan adjuk hozzá egy buret segítségével. A hozzáadott titráló térfogatát ezután úgy lehet meghatározni, hogy a titrálás előtt és után a buretben lévő folyadék szintjét leolvassa. Ez az olvasás általában a milliliter legközelebbi századára becsülhető, így a titráns pontos kiegészítése gyorsan elvégezhető.,
mivel az első néhány milliliter titráns beáramlik a lombikba, néhány mutató röviden rózsaszínre változik, de gyorsan visszatér színtelen. Ez annak köszönhető, hogy nagy mennyiségű ecetsav van. A NaOH korlátozó reagenst teljesen elfogyasztják.
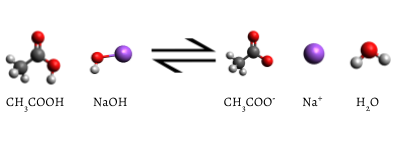
a hozzáadott indikátor rózsaszínre változik, amikor a titrálás befejeződött, jelezve, hogy az összes vizes ecetsavat a NaOH(AQ) fogyasztotta. A reakció a következő:
\
végül az összes ecetsavat elfogyasztják., Még egy csepp titráns töredékének hozzáadása tartós rózsaszín színt eredményez a lombikban lévő nem reagáló NaOH miatt. Az indikátor végpontján bekövetkező színváltozás azt jelzi, hogy az összes ecetsavat elfogyasztották, így elértük a titrálás egyenértékűségi pontját. Ha valamivel több NaOH oldatot adunk hozzá, akkor feleslegessé válik, és a lombikban lévő oldat színe sokkal sötétebb lesz. A végpont hirtelen megjelenik, és ügyelni kell arra, hogy ne lépje túl a végpontot.
miután a titrálás elérte a végpontot, a végleges kötet a buret-ből olvasható., A kezdeti és végső leolvasás segítségével a hozzáadott mennyiség pontosan meghatározható:
a titrálás célja mindig csak annyi titráló mennyiség hozzáadása, amennyi a titrált anyag mennyiségének pontos fogyasztásához szükséges. A NaOH-CH3COOH reakció Eq. \(\ref{2}\), az egyenértékűségi pont akkor fordul elő, amikor a kalibrált hengerből egyenlő moláris mennyiségű NaOH-t adtak hozzá minden CH3COOH mólhoz, amely eredetileg a titráló lombikban volt., Vagyis az egyenértékűségi ponton az elfogyasztott CH3COOH mennyiségéhez hozzáadott NaOH mennyiségének arányának meg kell egyeznie a
\
titrálással gyakran használják az oldat koncentrációjának meghatározására. Sok esetben nem egyszerű dolog tiszta anyagot előállítani, pontosan megmérni, és egy mérőlombikban feloldani, ahogy az az Oldatkoncentrációk 1. példájában történt. A NaOH például gyorsan kombinálódik a levegőből származó H2O-val és CO2-vel, így még a frissen elkészített szilárd NaOH minta sem lesz tiszta., Súlya folyamatosan változik, mivel a CO2(g) és a H2O(g) felszívódik. A hidrogén-klorid (HCl) egy gáz normál hőmérsékleten és nyomáson, így nagyon nehéz kezelni vagy mérlegelni. Mindkét anyag vizes oldatait szabványosítani kell, vagyis koncentrációjukat titrálással kell meghatározni.
messze a titrációk leggyakoribb használata az ismeretlenek meghatározása, vagyis az anyag koncentrációjának vagy mennyiségének meghatározása egy olyan mintában, amelyről kezdetben semmit sem tudtunk. A következő példa egy ismeretlen, hogy sok ember találkozik minden nap.,
Az ebben a példában kapott 308, 0 mg ésszerűen szoros egyetértésben van a gyártó 300 mg-os állításával. A tablettákat gépekkel préselik ki, nem egyenként mérik, ezért némi variáció várható.