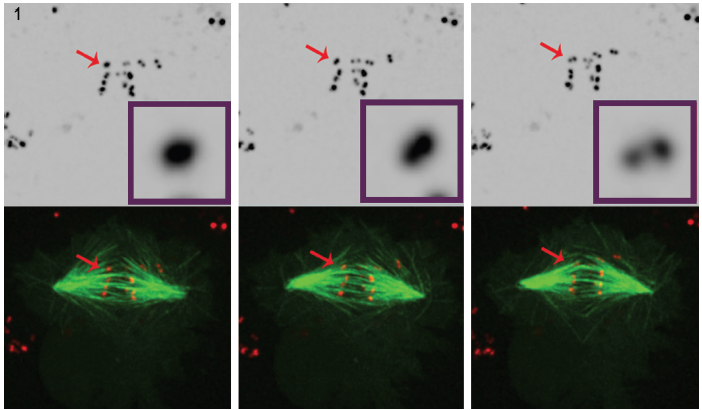
la Figure 1. Trois images fixes sélectionnées d’un film de cellules appauvries en POLO montrent clairement qu’au fil du temps, le signal centromère/kinétochore intense (rouge) se résout en une paire de points, ce qui démontre que les chromosomes sont attachés syntéliquement aux microtubules du fuseau (vert). Des ensembles de données de microscopie à fluorescence 4D ont été collectés toutes les 30 secondes avec 0.,5 mm z-étapes couvrant tout le volume de la cellule à l’aide d’un objectif plan apochromatique de 100°, 1.4 NA à 25°C avec l’unité confocale Revolution Spinning disk d’Andor et la caméra iXon EMCCD, tous deux pilotés par le logiciel Andor IQ live-cell imaging.
La division cellulaire mitotique repose sur la capacité des cellules à distribuer correctement les chromatides sœurs dans les cellules en formation. Pour effectuer de manière fiable la fonction, les cellules utilisent des mécanismes d’édition internes pour corriger les attachements de fibres chromosomiques / broches inexacts., Les kinétochores appariés sont généralement alignés pour fixer correctement les fibres de broche et séparer la chromatine, cependant, des kinétochores erronés et mal alignés en résultent. Les cellules contiennent des mécanismes d’édition spécialisés pour prévenir et corriger ces paires de kinétochores mal alignées, bien que le mécanisme exact ne soit pas bien compris 1,2 ., Il est postulé par Tatiana Moutinho-Santos à l’Universidade do Porto, Instituto de Biologia Molecular e Celular (IBMC) du Portugal que la présence de POLO kinase est nécessaire pour promouvoir la bi-orientation chromosomique (appelée arrangement amphitélique) et préserver ainsi le bon alignement des kinétochores.
Pour mieux comprendre son rôle dans la régulation du développement des kinétochores, le Dr Moutinho dos Santos a étudié la kinase appauvrie de la Drosophile POLO au sein de cellules vivantes afin de confirmer l’implication de POLO dans les fonctions d’édition nécessaires au maintien de l’arrangement des kinétochores amphitéliques., Dans ce cas, la disposition syntélique (kinétochores sœurs attachés à des microtubules émanant du même fuseau) a été étudiée. L’analyse timelapse de la mitose a été réalisée sur des cellules de Drosophile S2 exprimant de manière stable le CID-mCherry pour la visualisation des centromères, et la GFP-a-tubuline pour les microtubules. La visualisation des kinétochores est exigeante en raison de leur petite taille, de leur faible signal fluorescent et de leur brève apparence pendant la division cellulaire. La microscopie confocale à fluorescence est souvent utilisée pour l’image des kinétochores, cependant, même dans cet environnement, la visualisation reste difficile., Les kinétochores sont très petits (300 nm)3, proches des capacités de résolution latérales du microscope optique, et dépassent la capacité de résolution axiale du microscope. De plus, l’imagerie de marqueurs fluorescents dans des cellules vivantes présente des effets phototoxiques et photoblaisants potentiels. Un éclairage laser intense peut créer des problèmes de phototoxicité, particulièrement dommageables pour les cellules vivantes et en division.
La microscopie confocale à disque tournant Revolution XD d’Andor est utilisée pour surmonter le défi unique du Dr Moutinho dos Santo associé à l’observation des kinétochores., Dans ce cas, quatre facteurs distincts doivent être abordés simultanément pour visualiser adéquatement les processus cellulaires dynamiques:
- Vitesse d’acquisition
- Capacité de résolution spatiale et temporelle
- Capacité de détecter de très faibles niveaux d’intensité de fluorescence
- Gestion du signal de fluorescence disponible
Ces thèmes de résolution spatiale, temporelle et d’intensité reviennent fréquemment avec la microscopie à fluorescence et sont souvent en contradiction avec les expériences impliquant l’observation de la viabilité cellulaire., Par exemple, de longues expositions à l’appareil photo et de longues périodes d’éclairage à haute intensité génèrent les effets phototoxiques qui endommagent ou détruisent les cellules vivantes. Simultanément, les microstructures légèrement marquées exigent une exposition plus longue à visualiser, mais peuvent être affectées négativement par le photobleaching. Le problème est aggravé par la nécessité de combiner les données tridimensionnelles traditionnelles avec celles du temps. Enfin, il reste nécessaire de discerner le signal du bruit de fond et de la brume de focalisation.
La rapidité d’acquisition revêt une importance particulière pour le Dr Mountinho dos Santos., Les cellules témoins S2 présentent un cycle de division d’environ 30 minutes. Cependant, les cellules S2 appauvries de POLO utilisées dans ses expériences ont montré une période arrêtée supérieure à huit heures. L’enregistrement de la division cellulaire appauvrie par POLO nécessite la collecte de 7 200 à 12 000 jeux d’images (deux fluorochromes imagés toutes les trente secondes pendant une à cinq heures, acquis à des pas axiaux de 0,5 micron jusqu’à 20 pas pour une résolution kinétochore axiale)., La microscopie à fluorescence conventionnelle et l’éclairage laser ne permettront ni les exigences d’éclairage doux nécessaires ni la vitesse d’acquisition pour accomplir cette tâche sensible au temps. Par exemple, le rastering laser en microscopie confocale traditionnelle nécessite des périodes de temps plus longues pour collecter le signal de l’échantillon. Les systèmes confocaux à disque tournant sont utilisés pour surmonter ces barrières traditionnelles et pour révéler de nouvelles connaissances sur les techniques d’édition de kinétochores moléculaires.,
Par rapport aux systèmes conventionnels de fluorescence à champ large, la résolution spatiale d’un disque en rotation confocale est supérieure tant en dimensions latérale (x et y) qu’axiale (z). Grâce au balayage constant du réseau de sténopé, les échantillons peuvent être visualisés en temps réel à contraste élevé, fournissant des images claires aux limites de diffraction de l’optique du microscope. Cela permet la visualisation 3D et la compréhension du comportement dynamique des kinétochores par rapport aux microtubules de la broche., La résolution latérale du kinétochore et du centromère de 300 nm et la résolution de la fibre de broche de 300-500 nm ont été rapportées et sont détaillées dans la figure A.
Résolution d’intensité
La visualisation des kinétochores marqués par fluorescence associés à chaque centromère impose des exigences supplémentaires au système d’acquisition. Les centromères et les kinétochores étudiés ne sont principalement visibles que pendant l’interphase de division cellulaire. Au fur et à mesure que les cellules passent par la prophase, les centromères se sont déjà résolus en douze paires de chromosomes typiques de la drosophile., La gestion du budget de lumière disponible lors d’une acquisition longue nécessite un éclairage doux et une haute résolution capable de tourner des techniques de disque. Les ouvertures dans l’unité de disque de rotation fournissent ces avantages. Comme la lumière n’excite les fluorophores que lorsqu’une ouverture est présente, les effets phototoxiques sont minimisés. Bien que contre-intuitif, un budget de lumière réduit n’indique pas d’objets faibles et difficiles à détecter. La résolution d’intensité est augmentée grâce à l’exclusion du signal de mise au point du disque tournant et à l’amplification ultérieure du signal par une architecture de caméra EMCCD., Cela crée la nouvelle possibilité de générer des images à contraste plus élevé révélant le développement et l’alignement d’objets ponctuels tels que les kinétochores.
Conclusions
L’utilisation de la technologie de disque tournant dans l’application de cellules vivantes du Dr Mountinho dos Santos a conduit à une observation importante. En l’absence de la kinase POLO, il a été démontré que les cellules de Drosophile n’avaient pas les mécanismes correctifs nécessaires pour maintenir l’arrangement chromosomique amphitélique., Il a été démontré que la présence de POLO fournit le bon environnement pour une architecture correcte des centromères, tout en assurant une bi-orientation chromosomique appropriée. Les cellules de drosophile cultivées subissant une mitose en l’absence de chromosomes POLO kinase s’attachent aux fibres du fuseau avec une orientation syntélique, c’est-à-dire avec des kinétochores sœurs attachés à des microtubules provenant d’un seul pôle de fuseau.
Cette conclusion a été tirée par une analyse minutieuse de la microscopie à fluorescence 4D dans des cellules exprimant un marqueur centromère/ kinétochore marqué par fluorescence et des microtubules. (Figure 1).