Protéines membranaires
Alors que les lipides sont les éléments structurels fondamentaux des membranes, les protéines sont responsables de la réalisation de fonctions membranaires spécifiques. La plupart des membranes plasmatiques sont constituées d’environ 50% de lipides et 50% de protéines en poids, les parties glucidiques des glycolipides et des glycoprotéines constituant 5 à 10% de la masse membranaire. Étant donné que les protéines sont beaucoup plus grandes que les lipides, ce pourcentage correspond à environ une molécule de protéine pour 50 à 100 molécules de lipides., En 1972, Jonathan Singer et Garth Nicolson ont proposé le modèle en mosaïque fluide de la structure membranaire, qui est maintenant généralement accepté comme le paradigme de base pour l’organisation de toutes les membranes biologiques. Dans ce modèle, les membranes sont considérées comme des fluides bidimensionnels dans lesquels des protéines sont insérées dans des bicouches lipidiques (Figure 12.3).

Figure 12.3
Fluide mosaïque modèle de la membrane plasmique., Les protéines membranaires intégrales sont insérées dans la bicouche lipidique, tandis que les protéines périphériques sont liées à la membrane indirectement par des interactions protéine-protéine. La plupart des protéines membranaires intégrales sont transmembranaires (plus…Singer et Nicolson ont distingué deux classes de protéines associées à la membrane, qu’ils ont appelées protéines membranaires périphériques et intégrales., Les protéines membranaires périphériques ont été définies de manière opérationnelle comme des protéines qui se dissocient de la membrane après des traitements avec des réactifs polaires, tels que des solutions à pH extrême ou à forte concentration de sel, qui ne perturbent pas la bicouche phospholipidique. Une fois dissociées de la membrane, les protéines membranaires périphériques sont solubles dans des tampons aqueux. Ces protéines ne sont pas insérées dans l’intérieur hydrophobe de la bicouche lipidique. Au lieu de cela, ils sont indirectement associés aux membranes par le biais d’interactions protéine-protéine., Ces interactions impliquent fréquemment des liaisons ioniques, qui sont perturbées par un pH extrême ou une teneur élevée en sel.
Contrairement aux protéines membranaires périphériques, les protéines membranaires intégrales ne peuvent être libérées que par des traitements qui perturbent la bicouche phospholipidique. Des parties de ces protéines membranaires intégrales sont insérées dans la bicouche lipidique, de sorte qu’elles ne peuvent être dissociées que par des réactifs qui perturbent les interactions hydrophobes., Les réactifs les plus couramment utilisés pour la solubilisation des protéines membranaires intégrales sont les détergents, qui sont de petites molécules amphipathiques contenant à la fois des groupes hydrophobes et hydrophiles (Figure 12.4). Les parties hydrophobes de détergents déplacent les lipides membranaires et se lient aux parties hydrophobes de protéines membranaires intégrales. Étant donné que l’autre extrémité de la molécule de détergent est hydrophile, les complexes détergents-protéines sont solubles dans des solutions aqueuses.

Figure 12.4
la Solubilisation des protéines membranaires intégrales par les détergents., Les détergents (par exemple, le glucoside d’octyle) sont des molécules amphipathiques contenant des groupes de tête hydrophiles et des queues hydrophobes. Les queues hydrophobes se lient aux régions hydrophobes de la membrane intégrale (plus…)
De nombreuses protéines intégrales sont des protéines transmembranaires, qui couvrent la bicouche lipidique avec des parties exposées des deux côtés de la membrane. Ces protéines peuvent être visualisées dans des micrographies électroniques de membranes plasmatiques préparées par la technique de gel-fracture (voir Figure 1.35). Chez ces spécimens, la membrane est fendue et se sépare en deux folioles., Les protéines transmembranaires sont alors apparentes sous forme de particules sur les faces internes de la membrane (Figure 12.5).

Figure 12.5
cryofracture microscope électronique des cellules rouges du sang humain membranes. Les particules dans la membrane sont des protéines transmembranaires. (Harold H. Edwards / Visuals Unlimited.,
Les parties membranaires des protéines transmembranaires sont généralement des hélices α de 20 à 25 acides aminés hydrophobes qui sont insérées dans la membrane du réticulum endoplasmique lors de la synthèse de la chaîne polypeptidique (voir Figures 9.11, 9.12 et 9.13). Ces protéines sont ensuite transportées dans des vésicules membranaires du réticulum endoplasmique vers l’appareil de Golgi, et de là vers la membrane plasmique., Les groupes glucidiques sont ajoutés aux chaînes polypeptidiques dans le réticulum endoplasmique et l’appareil de Golgi, de sorte que la plupart des protéines transmembranaires de la membrane plasmique sont des glycoprotéines avec leurs oligosaccharides exposés à la surface de la cellule.
Des études sur les globules rouges ont fourni de bons exemples de protéines périphériques et intégrales associées à la membrane plasmique. Les membranes des érythrocytes humains contiennent environ une douzaine de protéines majeures, qui ont été identifiées à l’origine par électrophorèse sur gel de préparations membranaires., La plupart d’entre elles sont des protéines membranaires périphériques qui ont été identifiées comme des composants du cytosquelette cortical, qui sous-tend la membrane plasmique et détermine la forme de la cellule (voir Chapitre 11). Par exemple, la protéine membranaire périphérique la plus abondante des globules rouges est la spectrine, qui est la principale protéine cytosquelettique des érythrocytes. D’autres protéines membranaires périphériques des globules rouges comprennent l’actine, l’ankyrine et la bande 4.1., L’ankyrine sert de lien principal entre la membrane plasmique et le cytosquelette en se liant à la fois à la spectrine et à la bande protéique membranaire intégrale 3 (voir Figure 11.11). Un lien supplémentaire entre la membrane et le cytosquelette est fourni par la bande 4.1, qui se lie aux jonctions de la spectrine et de l’actine, ainsi qu’à la glycophorine (l’autre protéine membranaire intégrale majeure des érythrocytes).
Les deux principales protéines membranaires intégrales des globules rouges, la glycophorine et la bande 3, fournissent des exemples bien étudiés de structure protéique transmembranaire (Figure 12.6)., La glycophorine est une petite glycoprotéine de 131 acides aminés, d’un poids moléculaire d’environ 30 000, dont la moitié est constituée de protéines et la moitié de glucides. La glycophorine traverse la membrane avec une seule hélice α couvrant la membrane de 23 acides aminés, avec sa partie amino-terminale glycosylée exposée à la surface de la cellule. Bien que la glycophorine ait été l’une des premières protéines transmembranaires à être caractérisée, sa fonction précise reste inconnue. En revanche, la fonction de l’autre protéine transmembranaire majeure des globules rouges est bien comprise., Cette protéine, connue à l’origine sous le nom de bande 3, est le transporteur d’anions responsable du passage des ions bicarbonate (HCO3-) et chlorure (Cl-) à travers la membrane des globules rouges. La chaîne de polypeptide de la bande 3 est 929 acides aminés et on pense avoir 14 régions α-hélicoïdales couvrant la membrane. À l’intérieur de la membrane, les dimères de la bande 3 forment des structures globulaires contenant des canaux internes à travers lesquels les ions peuvent voyager à travers la bicouche lipidique.
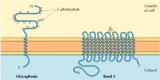
Figure 12.6
protéines Intégrales de membrane des globules rouges., La glycophorine (131 acides aminés) contient une seule hélice α transmembranaire. Il est fortement glyocosylé, avec des oligosaccharides attachés à 16 sites sur la partie extracellulaire de la chaîne polypeptidique. (plus…)
En raison de leur caractère amphipathique, les protéines transmembranaires se sont avérées difficiles à cristalliser, comme cela est requis pour l’analyse structurale tridimensionnelle par diffraction des rayons X., La première protéine transmembranaire à être analysée par cristallographie aux rayons X a été le centre de réaction photosynthétique de la bactérie Rhodopseudomonas viridis, dont la structure a été rapportée en 1985 (Figure 12.7). Le centre de réaction contient trois protéines transmembranaires, désignées L, M et H (légères, moyennes et lourdes) selon leurs tailles apparentes indiquées par électrophorèse sur gel. Les sous-unités L et M ont chacune cinq hélices α couvrant la membrane. La sous-unité H n’a qu’une seule hélice α transmembranaire, la majeure partie de la chaîne polypeptidique se trouvant du côté cytosolique de la membrane., La quatrième sous-unité du centre de réaction est un cytochrome, qui est une protéine membranaire périphérique liée au complexe par des interactions protéine-protéine.

Figure 12.7
Une bactérie photosynthétique centre réactionnel. Le centre de réaction se compose de trois protéines transmembranaires, désignées L (rouge), M (jaune) et H (vert). Les sous-unités L et M ont chacune cinq hélices α transmembranaires, alors que la sous-unité H n’a que (plus…)
Bien que la plupart des protéines transmembranaires couvrent la membrane par des régions α-hélicoïdales, ce n’est pas toujours le cas., Une exception bien caractérisée est fournie par les porines-une classe de protéines qui forment des canaux dans les membranes externes de certaines bactéries. De nombreuses bactéries, y compris E. coli, ont un système à double membrane dans lequel la membrane plasmique (ou membrane interne) est entourée par la paroi cellulaire et une membrane externe distincte (figure 12.8). Contrairement à la membrane plasmique, la membrane externe est très perméable aux ions et aux petites molécules polaires (dans le cas d’E. coli, avec des poids moléculaires allant jusqu’à 600). Cette perméabilité résulte des porines, qui forment des canaux aqueux ouverts à travers la bicouche lipidique., Comme discuté au chapitre 10, des protéines liées aux porines bactériennes se trouvent également dans les membranes externes des mitochondries et des chloroplastes.
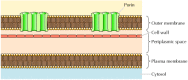
Figure 12.8
Bactérienne des membranes externes. La membrane plasmique de certaines bactéries est entourée d’une paroi cellulaire et d’une membrane externe distincte. La membrane externe contient des porines, qui forment des canaux aqueux ouverts permettant le libre passage des ions et des petites molécules.
L’analyse structurelle a indiqué que les porines ne contiennent pas de régions α-hélicoïdales hydrophobes., Au lieu de cela, ils traversent la membrane sous forme de barils β, dans lesquels 16 feuilles β se replient en une structure en forme de tonneau enfermant un pore aqueux (Figure 12.9). Les chaînes latérales des acides aminés polaires ligne les pores, tandis que les chaînes latérales des acides aminés hydrophobes interagir avec l’intérieur de la membrane. Les monomères de porine s’associent pour former des trimères stables, chacun contenant trois canaux ouverts à travers lesquels les molécules polaires peuvent diffuser à travers la membrane.

Figure 12.9
la Structure d’une porine monomère., Chaque monomère est un baril β constitué de 16 brins β antiparallèles (flèches). L’extrémité supérieure de la molécule fait face au milieu externe. (Extrait de H. Nikaido, 1994. J. Biol. Chem. 269: 3905.)
Contrairement aux protéines transmembranaires, une variété de protéines (dont beaucoup se comportent comme des protéines membranaires intégrales) sont ancrées dans la membrane plasmique par des lipides ou des glycolipides attachés de manière covalente (Figure 12.10). Les membres d’une classe de ces protéines sont insérés dans le feuillet externe de la membrane plasmique par des ancres de glycosylphosphatidylinositol (GPI)., Des ancres GPI sont ajoutées à certaines protéines qui ont été transférées dans le réticulum endoplasmique et sont ancrées dans la membrane par une région transmembranaire C-terminale (voir Figure 9.16). La région transmembranaire est clivée lorsque l’ancre GPI est ajoutée, de sorte que ces protéines restent attachées à la membrane uniquement par le glycolipide. Étant donné que les chaînes polypeptidiques des protéines ancrées dans le GPI sont transférées dans le réticulum endoplasmique, elles sont glycosylées et exposées à la surface de la cellule après leur transport vers la membrane plasmique.
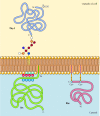
la Figure 12.,10
Exemples de protéines ancrées dans la membrane plasmique par des lipides et des glycolipides. Certaines protéines (par exemple, la protéine lymphocytaire Thy-1) sont ancrées dans le feuillet externe de la membrane plasmique par des ancres GPI ajoutées à leur extrémité C dans le réticulum endoplasmique. (plus…)
d’Autres protéines sont ancrés dans le feuillet interne de la membrane plasmique par liaison covalente des lipides. Plutôt que d’être traitées par la voie sécrétoire, ces protéines sont synthétisées sur des ribosomes cytosoliques libres, puis modifiées par addition de lipides., Ces modifications comprennent l’ajout d’acide myristique (un acide gras à 14 carbones) à l’extrémité aminée de la chaîne polypeptidique, l’ajout d’acide palmitique (16 carbones) aux chaînes latérales des résidus de cystéine et l’ajout de groupes prényle (15 ou 20 carbones) aux chaînes latérales des résidus de cystéine carboxy-terminale (voir Figures 7.29, 7.30 et 7.31). Dans certains cas, ces protéines (dont beaucoup se comportent comme des protéines membranaires périphériques) sont ciblées sur la membrane plasmique par des régions chargées positivement de la chaîne polypeptidique ainsi que par les lipides attachés., Ces domaines protéiques chargés positivement peuvent interagir avec les groupes de tête chargés négativement de la phosphatidylsérine sur la face cytosolique de la membrane plasmique. Il est à noter que de nombreuses protéines ancrées dans le feuillet interne de la membrane plasmique (y compris les protéines Src et Ras illustrées à la Figure 12.10) jouent un rôle important dans la transmission des signaux des récepteurs de surface cellulaire aux cibles intracellulaires, comme nous le verrons dans le chapitre suivant.