nom commun: sauterelle de l’est nom scientifique: Romalea microptera (Palisot de Beauvois) (Insecta: Orthoptera: Romaleidae)
Cette sauterelle est bien connue dans le sud-est des États-Unis et ailleurs, en raison de sa grande taille et de son utilisation répandue dans les classes de biologie pour les exercices de dissection. En outre, il peut être d’une importance économique en Floride. C’est l’une des rares espèces de sauterelles en Floride qui se produit en assez grand nombre pour causer de graves dommages aux agrumes, aux cultures maraîchères et aux plantes ornementales du paysage., Malheureusement, la communauté scientifique utilise deux noms scientifiques différents pour la même espèce, et Romalea microptera (Palisot de Beauvois) est également appelée Romalea guttata (Houttuyn). Techniquement, ce dernier est probablement le nom correct (Kevan 1980), mais comme l’ancienne désignation a été utilisée pendant de nombreuses années, cette « correction » proposée a introduit une confusion inutile (Cohn 1999), de sorte que la plupart des scientifiques continuent de l’appeler Romalea microptera.
Le lubber oriental est assez maladroit et lent en mouvement et se déplace principalement en marchant et en rampant faiblement sur le substrat., La désignation « lubber » est intéressante car elle décrit bien cette sauterelle. « Lubber « est dérivé d’un vieux mot anglais” lobre » qui signifie paresseux ou maladroit. Ce terme est venu à signifier un grand, maladroit, et personne stupide, également connu comme un lout ou lummox. Dans les temps modernes, il n’est normalement utilisé que par les gens de mer, qui qualifient les novices de « landlubbers”., Le lubber oriental est l’une des quatre seules espèces de la famille des Romaleidae que l’on trouve au nord du Mexique, mais il existe de nombreuses autres espèces en Amérique du Sud (Rehn et Grant, 1961), et beaucoup sont ailées et agiles, donc bien que certaines autres espèces de cette famille puissent être appelées lubbers, la désignation « lubber” n’est pas appropriée pour toute la famille.
Répartition (Haut de page)
La sauterelle lubber de l’est est limitée à la région sud-est des États-Unis., On le trouve de la Caroline du Nord au sud en passant par la Caroline du Sud, la Géorgie et la Floride, et à l’ouest en passant par l’Alabama, le Mississippi et la Louisiane jusqu’au centre du Texas (Capinera et al. 2004).
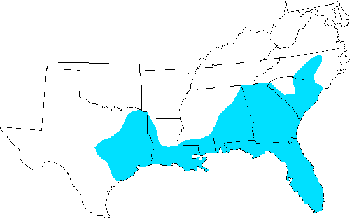
la Figure 1. Distribution de Romalea microptera, la sauterelle lubber de l’est.
Description (Retour en haut de page)
La sauterelle lubber orientale est certainement l’espèce de sauterelle la plus distinctive trouvée dans le sud-est des États-Unis. Les adultes sont colorés, mais le motif de couleur varie., Souvent, le lubber oriental adulte est principalement jaune ou fauve, avec du noir sur la partie distale des antennes, sur le pronotum et sur les segments abdominaux. Les ailes antérieures s’étendent des deux tiers aux trois quarts de la longueur de l’abdomen. Les ailes postérieures sont courtes et incapables de fournir une portance pour le vol. Les ailes antérieures ont tendance à être de couleur rose ou rose au centre, tandis que les ailes postérieures sont entièrement de couleur rose., Des formes plus sombres de cette espèce existent également, dans lesquelles la couleur jaune devient la composante mineure plutôt que la composante principale de la couleur, et dans le nord de la Floride, une forme principalement noire est parfois trouvée. Les adultes atteignent une grande taille, les mâles mesurant 43-55 mm de longueur et les femelles mesurant souvent 50-70 mm, parfois 90 mm.Non seulement cette grande sauterelle au corps lourd est incapable de voler, mais elle est également pauvre en sauts. Cependant, c’est un bon grimpeur et grimpe souvent aux arbres pour se nourrir du feuillage juvénile au bout des branches.,
Les deux sexes stridulent (font du bruit) en frottant l’aile antérieure contre l’aile postérieure. Lorsqu’ils sont alarmés, les lubbers déploient leurs ailes, sifflent et sécrètent de la mousse nauséabonde de leurs spiracles. Ils peuvent expulser un jet fin de produits chimiques toxiques sur une distance de 15 cm. La décharge chimique du système trachéal est considérée comme une défense anti-prédateur et consiste en des produits chimiques synthétisés et séquestrés dans l’alimentation. La variation des toxines assimilées par l’alimentation rend difficile l’adaptation des prédateurs aux toxines (Chapman et Joern, 1990)., De nombreux prédateurs vertébrés, mais pas invertébrés, sont touchés (Jones et al. 1987, 1989; Whitman et coll. 1992). Leur motif de couleur vive est considéré comme un avertissement aux prédateurs vertébrés que les lubbers ne sont pas agréables au goût. Leur tendance à s’agréger et à escalader la végétation, surtout la nuit, est une composante de leur comportement défensif.
Oeufs. Les œufs des sauterelles lubber sont de couleur jaunâtre ou brune. Ils sont de forme elliptique allongée et mesurent environ 9,5 mm de longueur et 2,5 mm de largeur., Ils sont pondus en grappes soigneusement disposées, ou gousses, qui se composent de rangées d’œufs positionnés parallèlement les uns aux autres, et maintenus ensemble par une sécrétion. Normalement, il y a 30 à 50 œufs dans chaque gousse. Les femelles ovipositives préfèrent les habitats mixtes de pins à feuilles larges avec des niveaux intermédiaires d’humidité du sol, évitant à la fois les sols de plaine, humides et compacts et les sols secs et sablonneux des hautes terres (Watson, 1941; Kuitert et Connin, 1953). La femelle dépose la gousse dans le sol à une profondeur de 3-5 cm et ferme le trou de ponte avec une sécrétion mousseuse ou un bouchon., Le bouchon permet aux jeunes sauterelles d’accéder facilement à la surface du sol lorsqu’elles éclosent. Les gousses d’œufs ont tendance à être groupées, les femelles oviposant préférentiellement là où les œufs ont déjà été déposés (Stauffer et al. 1998). Selon Hunter-Jones (1967), les femelles produisent chacune 3 à 5 grappes d’œufs dans des structures appelées gousses. La gousse n’est pas beaucoup plus que des œufs serrés entourés d’un matériau rigide et mousseux, la majeure partie de la mousse étant déposée à l’extrémité de la gousse la plus proche de la surface. La mousse permet une sortie facile pour les jeunes trémies car ils peuvent facilement se mouvoir à travers cela pendant qu’ils éclosent., L’intervalle entre la production de cosses par une femelle est d’environ 2 semaines. Hunter-Jones a signalé une production d’œufs de 30 à 80 œufs par gousse, soit une moyenne d’environ 60 œufs par gousse. La production d’œufs était plus importante dans des conditions solitaires que dans des conditions de surpeuplement. D’autre part, dans des conditions de terrain, Stauffer et Whitman (2007) ont signalé une production d’œufs de 25 à 50 œufs par gousse, avec seulement 1 à 3 gousses par femelle. Ainsi, la production d’œufs en laboratoire était plus importante que sur le terrain. Les œufs nécessitent une période fraîche (par exemple, 20°C pendant 3 mois), mais éclosent lorsqu’ils sont exposés à des températures plus chaudes., En règle générale, l’éclosion des œufs se produit le matin.
les Nymphes. La sauterelle lubber de l’Est immature diffère considérablement en apparence des adultes (Capinera et al. 1999, 2001). Leur motif de couleur est si différent du stade adulte que les nymphes sont généralement confondues avec une espèce différente de la forme adulte. Les nymphes (sauterelles immatures) sont généralement presque entièrement noires, mais avec une bande jaune, orange ou rouge distinctive située dorsalement (bien que parfois elles soient brun rougeâtre)., La face de la trémie, le bord du pronotum et les segments abdominaux peuvent également contenir des accents rougeâtres. Souvent, les accents rougeâtres changent en jaune au cours du développement. Lors de leur première mue, les jeunes trémies peuvent être brunâtres, mais elles s’assombrissent rapidement pour devenir noires.
À mesure qu’elles mûrissent, les nymphes changent légèrement d’apparence; le stade peut être déterminé par l’examen des ailes en développement. Normalement, il y a 5 stades, bien que parfois 6 stades se produisent., Les premiers stades peuvent être distingués par une combinaison de la taille du corps, du nombre de segments antennaires et de la forme des ailes en développement. Les nymphes mesurent environ 10-12, 16-20, 22-25, 30-40 et 35-45 mm de longueur pendant les stades 1-5, respectivement. Segments antennaires, qui peuvent être difficiles à distinguer même avec un grossissement, nombre 12, 14-16, 16-18, 20, et 20 segments par antenne pendant les stades 1-5, respectivement. Les formes des plaques immédiatement derrière le pronotum (les futures ailes) changent légèrement à chaque mue., Au premier stade, la surface ventrale est largement arrondie; au deuxième stade, les bords ventraux commencent à se rétrécir légèrement et pointent légèrement vers l’arrière, et acquièrent également une légère indication de nervation; au troisième stade, les bords ventraux des plaques sont nettement allongés, pointent fortement vers l’arrière et les veines sont prononcées. À la mue au quatrième stade, l’orientation des petites ailes en développement passe de la pointe vers le bas à la pointe vers le haut et vers l’arrière., Au stade 4, les petites ailes antérieures et postérieures sont discrètes et ne se chevauchent pas, bien que les ailes antérieures puissent être complètement ou partiellement cachées sous le pronotum. Au stade 5, les ailes légèrement plus grandes se chevauchent, semblant n’être qu’une seule paire d’ailes. Même au cinquième stade, cependant, les bourgeons alaires ne couvrent pas le tympan. Chez les adultes, cependant, les ailes se chevauchent et recouvrent le tympan, s’étendant vers l’arrière pour couvrir 3-4 segments abdominaux.
Les jeunes nymphes sont très grégaires et restent grégaires pendant la majeure partie de la période nymphale, bien que l’intensité se dissipe avec le temps., Surtout la nuit, ils ont tendance à s’agréger et peuvent grimper à la végétation pour se reposer le soir.
la Figure 2. Jeune lubber, Romalea microptera (Beauvois), stade un. Les segments au-dessus des deuxième et troisième pattes portent des bourgeons alaires, bien qu’à ce stade ils soient à peine visibles. Photographie de Lyle J. Buss, Université de Floride.
la Figure 3. Jeune lubber, Romalea microptera (Beauvois), stade deux. Les débuts des veines des ailes peuvent être vus maintenant. Photographie de Lyle J. Buss, Université de Floride.,
la Figure 4. Jeune lubber, Romalea microptera (Beauvois), stade trois. Maintenant, vous pouvez mieux voir les veines en développement et une légère extension arrière (postérieure) des bourgeons alaires. Photographie de Lyle J. Buss, Université de Floride.
la Figure 5. Jeune lubber, Romalea microptera (Beauvois), stade quatre. Maintenant, vous pouvez voir quelque chose qui ressemble réellement à une aile, bien qu’il soit assez petit. Notez qu’il est pointé vers le haut (dorsalement)., Notez également sa longueur par rapport au tympan ovale de couleur rougeâtre sur le premier segment abdominal. Photographie de Lyle J. Buss, Université de Floride.
la Figure 6. Jeune lubber, Romalea microptera (Beauvois), stade cinq. L’aile est plus longue maintenant, s’étendant plus en arrière par rapport au tympan. Ensuite, il muera à l’adulte, bien que vous ne puissiez pas dire de la nymphe quelle forme de couleur sera assumée par l’adulte. Photographie de John Capinera, Université de Floride.,
la Figure 7. Nymphe lubber Romalea microptera (Beauvois), mue, laissant derrière elle son vieux corps (plus sombre) couvrant. Photographie de Lyle J. Buss, Université de Floride.
les Adultes. Les mâles et les femelles adultes mesurent généralement 6,0 et 8,0 cm. longtemps, respectivement. Le corps est assez robuste tandis que les jambes restent relativement minces. La couleur générale des adultes est jaune terne avec divers degrés de taches noires et de marques., La paire d’ailes antérieures (tegmina) est jaune avec de nombreux points noirs dispersés, tandis que les ailes postérieures lorsqu’elles sont exposées révèlent une coloration rouge vif/rose avec une bordure noire. La couleur des lubbers adultes varie également dans la majeure partie de la gamme de l’insecte. Une phase est presque entièrement noire (mélanique) avec quelques marques de jaunâtre. Les adultes de cette phase mélanique semblent ressembler à la nymphe, mais seulement en couleur. Les individus de la même zone géographique peuvent être jaunâtres, mélaniques ou quelque part entre les deux., Cependant, malgré leurs apparences différentes, ces sauterelles d’apparence différente sont de la même espèce et s’accoupleront avec succès.
la Figure 8. Sauterelle lubber de l’est adulte, Romalea microptera (Beauvois), phase de couleur claire. Photographie de John Capinera, Université de Floride.
La couleur des lubbers adultes varie également dans la majeure partie de l’aire de répartition de l’insecte. Une phase est presque entièrement noire avec quelques marques de fauve jaunâtre. Les adultes de cette phase semblent ressembler à la nymphe., Cependant, les différentes phases sont bien la même espèce.
la Figure 9. Sauterelle lubber de l’Est adulte, Romalea microptera (Beauvois), phase de couleur intermédiaire. Photographie de John Capinera, Université de Floride.
la Figure 10. Sauterelle lubber de l’est adulte, Romalea microptera (Beauvois), phase de couleur foncée. Photographie de John Capinera, Université de Floride.
la Figure 11., Forme de couleur noire de la sauterelle lubber de l’est adulte, Romalea microptera (Beauvois). Photographie de Lyle J. Buss, Université de Floride.
Cycle de vie (Retour en haut de page)
Il y a une génération par an, avec le stade de l’œuf hivernant. Apparemment, il n’y a pas de diapause obligatoire (période de dormance requise) au stade de l’œuf; ils ont simplement une longue période de développement (environ 200 jours) lorsqu’ils sont maintenus à basse température (Hunter-Jones 1967)., Ces sauterelles ont une longue vie, et les nymphes ou les adultes sont présents pendant la majeure partie de l’année dans les parties sud de la Floride. Dans le nord de la Floride et le long de la côte du Golfe, ils peuvent être trouvés de mars-avril à environ Octobre-Novembre. En Floride, le plus grand nombre d’adultes peut être observé pendant les mois de juillet et août. Les œufs sont produits environ un mois après l’apparition des adultes. La durée du stade de l’œuf est de 6-8 mois.
Après l’accouplement, les femelles commencent à pondre pendant les mois d’été., Le mâle garde généralement la femelle ovipositing, parfois pendant plus d’une journée. Le moment de la ponte est très variable, mais les femelles ovipositives choisissent des zones ouvertes et ensoleillées de plus haute altitude, puis utilisent la pointe de l’abdomen pour creuser un petit trou dans une parcelle de sol appropriée. Habituellement à une faible profondeur, mais parfois jusqu’à une profondeur d’environ 5 cm, elle déposera ses œufs dans une mousse mousseuse légère. Ces œufs resteront dans le sol à la fin de l’automne et de l’hiver, puis commenceront à éclore au printemps., Les jeunes sauterelles rampent hors du sol à l’éclosion et se rassemblent près de sources de nourriture appropriées. Les lubbers se trouvent souvent dans des habitats humides ou humides, mais recherchent des sites plus secs pour la ponte.
la Figure 12. Accouplement des adultes de deux formes de couleur. Photographie de Lyle J. Buss, Université de Floride.
Les populations montent et descendent, probablement en raison de l’action des parasites. La mouche tachinidée Anisia serotina (Reinhard) atteint des niveaux élevés de parasitisme, parfois de 60 à 90% (Lamb et al. 1999)., Nous avons également trouvé les sarcophagides Blaesoxipha opifera (Coquillett) et Blaesoxipha hunter (Hough) parasitant cette sauterelle, parfois à forte incidence de parasitisme (inédit; identifié par G. A. Dahlem, Northern Kentucky University). Les agents pathogènes connus de Romalea microptera comprennent Boliviana floridensis (Stauffer et Whitman 2007) et Encephalitozoon romaleae (Lange et al. 2009).
Dans l’ensemble, les ennemis naturels des sauterelles lubber sont mal documentés., Les prédateurs vertébrés tels que les oiseaux et les lézards apprennent à éviter ces insectes en raison de la production de sécrétions toxiques par les trémies adultes, bien que cela ne soit pas absolu (Chapman et Joern, 1990). Les vertébrés naïfs gag, régurgitent et meurent parfois à la suite de la consommation de lubbers (Yousef et Whitman, 1992). Cependant, les pies-grièches, Lanius ludovicianus Linnaeus, capturent et cachent les lubbers en les empalant sur les épines et les barbes de la clôture de barbelés. Après 1-2 jours, les toxines se dégradent et les lubbers morts deviennent comestibles pour les pie-grièche (Yousef et Whitman, 1992)., En plus des mouches parasites, des nématodes ont été signalés chez les lubbers, et il est possible d’infecter les lubbers expérimentalement avec le nématode infectant les sauterelles Mermis nigrescens.
la Figure 13. L’une des espèces de mouches parasites (Blaesoxipha hunteri) qui affecte les lubbers. Les larves se développent au sein des nymphes, tuant leurs hôtes lorsqu’elles émergent. Photographie de Lyle J. Buss, Université de Floride.,
Habitat et hôtes (Haut de page)
La sauterelle lubber de l’Est a une large gamme d’hôtes. Au moins 100 espèces de 38 familles de plantes contenant des arbustes, des herbes, des mauvaises herbes à feuilles larges et des graminées seraient consommées (Whitman, 1988), bien que leurs pièces buccales soient mieux adaptées pour se nourrir de plantes à feuilles larges, et non de graminées (Squitier et Capinera, 2002). Parmi les plantes que l’on observe être mangées, on peut citer la pokeweed, Phytolaca americana; le Cnidoscolus stimmulosus; le pickerel weed, Pontederia cordata; la queue du lézard, Saururus sp.,; carex, Cyperus; et pointe de flèche, Sagittaria spp. Bien que son habitat préféré semble être des zones basses et humides dans les pâturages et les bois et le long des fossés, les lubbers se dispersent sur de longues distances pendant la période nymphale. Ils sont grégaires et incapables de voler, leurs migrations mettant parfois un grand nombre d’entre eux en contact avec des cultures où ils endommagent les légumes, certaines grandes cultures (arachides, niébé, maïs), les arbres fruitiers (agrumes, figues, pêche) et les plantes ornementales (Kuitert et Connin, 1953).,
La nature des insectes polyphages il d’accepter au moins de petites quantités de nombreuses plantes, une stratégie qui assure qu’ils ne mourront pas de faim. Cependant, toutes les plantes ne sont acceptés également. Par exemple, bien que les lubbers aient une large préférence parmi les cultures maraîchères, certaines plantes telles que le pois, la laitue, le chou frisé, les haricots et le chou sont relativement préférées, tandis que l’aubergine, la tomate, le poivre, le céleri, le gombo, le fenouil et le maïs sucré sont moins préférées (Capinera 2014). Ils défolient couramment l’amaryllis, le lis amazonien, le crinum, le narcisse et les plantes apparentées (famille des Amaryllidacées) dans les jardins de fleurs., Parmi les plantes ornementales, ils se nourrissent également facilement de lauriers roses, de mauvaises herbes à papillons, de peregrina, de pétunia mexicain et de lantana (Capinera 2014). Les mauvaises herbes préférées comprennent la feuille peinte, Poinsettia cyathophora; marcher doucement, Cnidoscolus stimulosus; chambre amère, Phyllanthus urinaria; Florida beggarweed, Desmodium tortuosum; Old-world diamond-flower, Oldenlandia corymbosa; Florida pusley, Richardia scabra; et lisse crabgrass, Digitaria ischaemum (Capinera 2014).
Dommages (Retour en haut)
Les sauterelles Lubber sont des défoliateurs, consommant le tissu foliaire de nombreuses plantes., Ils grimpent facilement, et parce qu’ils sont grégaires, ils peuvent déshabiller complètement le feuillage des plantes. Plus souvent, cependant, ils vont manger des trous irréguliers dans la végétation et ensuite passer à une autre feuille ou plante. Les sauterelles Lubber ne sont pas aussi dommageables que leur taille pourrait le suggérer; elles consomment moins de nourriture que les sauterelles plus petites (Griffiths et Thompson, 1952). Les dommages sont généralement associés aux zones qui supportent les mauvaises herbes ou les plantes semi-aquatiques telles que les fossés d’irrigation et de drainage, les bords d’extrémité des étangs., Les sauterelles qui se développent initialement dans ces zones se disperseront dans les cultures et les zones résidentielles, où elles causent des dommages. Ainsi, comme c’est le cas pour de nombreuses sauterelles, la surveillance et le traitement des zones où se produit le développement nymphal sont recommandés pour prévenir les dommages aux plantes économiquement importantes. Il est également utile de garder la végétation tondue, car la végétation courte est moins favorable aux sauterelles.
Gestion (Haut de page)
La gestion de ces insectes a tendance à dépendre de la capture (enlèvement physique) lorsque seulement quelques trémies sont présentes., Quand il y en a trop pour être contrôlé par la cueillette à la main, des insecticides peuvent être appliqués. Les insecticides peuvent être appliqués sur le feuillage ou directement sur la sauterelle. Cependant, en raison de leur grande taille et de leur capacité à détoxifier les toxines naturelles associées aux plantes alimentaires, ils s’avèrent souvent difficiles à tuer, en particulier en pulvérisant le feuillage., Les insecticides qui tueront les sauterelles lubber comprennent le carbaryl, la bifenthrine, la cyhalothrine, la perméthrine, l’esfenvalérate et le spinosad (remarque: ce sont les noms techniques des insecticides, pas les noms commerciaux; ces noms apparaissent dans la section « ingrédients » de l’étiquette). Spinosad est particulièrement intéressant parce que c’est un produit à base biologique, relativement sûr; malheureusement, il agit plutôt lentement sur les sauterelles, il peut donc prendre quelques jours pour voir les résultats du traitement., Le traitement insecticide est plus efficace pour les jeunes sauterelles, ce qui peut nécessiter de repérer les trémies dans les zones désherbées et de les traiter avant qu’elles ne se déplacent dans les jardins et les cultures. Une alternative consiste à traiter les marges des terres cultivées, peut-être les premiers mètres 1-20, de sorte que lorsque les trémies se dispersent à travers la culture à partir des bords, elles rencontrent la végétation traitée et périssent après l’échantillonnage. Parce qu’ils sont dispersifs et peuvent continuer à envahir une zone même après qu’elle a été traitée avec un insecticide, il peut être difficile d’assurer une protection aux plantes sans une surveillance et un retraitement diligents.,
Si les insecticides sont utilisés, assurez-vous de les appliquer selon les directives sur l’étiquette du contenant. Surtout si des insecticides sont appliqués sur les cultures vivrières ou près de l’eau, il est important de suivre les instructions. La plupart des insecticides énumérés ci-dessus sont toxiques pour les poissons.
Des appâts contenant des insecticides sont parfois formulés pour lutter contre les sauterelles; normalement, le son est le substrat sur lequel l’insecticide est appliqué et il est saupoudré à la surface du sol près des plantes protégées., Les lubbers acceptent de tels appâts, et les insectes sont facilement tués s’ils ingèrent le toxique et l’appât. Cependant, cette tactique fonctionne mieux lorsque l’appât est appliqué à proximité de plantes moins préférées, car les trémies auront tendance à manger les plantes hôtes favorisées de préférence à l’appât traité (Barbara et Capinera 2003, Capinera 2014). Le traitement des marges des champs avec des appâts peut aider à réduire les dommages causés aux cultures par les trémies immatures et incapables de voler telles que les lubbers, bien que le traitement des marges des champs soit moins efficace avec les espèces de sauterelles qui sont des mouches fortes telles que Schistocerca americana (Drury).,
la Figure 14. Jeunes nymphes de la sauterelle lubber orientale, Romalea microptera (Beauvois), groupées sur un citrus reset (jeune citrus). Photographie de John Capinera, Université de Floride.
Références sélectionnées (Retour en haut de page)
- Barbara, KA, Capinera JL. 2003. Développement d’un appât toxique pour lutter contre la sauterelle lubber (Orthoptera: Acrididae). Journal d’entomologie économique 96: 584-591.
- Blatchley WS. 1920. Orthoptera du Nord-est de l’Amérique., Maison d’édition Nature. Indianapolis, Indiana. p. 304-307.
- Capinera JL. 2014. Sélection des plantes hôtes par Romalea microptera (Orthoptera: Romaleidae). La Floride Entomologiste 97: 38-49.
- Capinera JL, Scherer CW, Squitier JM. 1999. Sauterelles de Floride. http://entomology.ifas.ufl.edu/ghopper/ghopper.html
- Capinera JL, Scherer CW, Squitier JM. 2001. Sauterelles de Floride. University Press de Floride. 143 pp.
- Capinera JL, Scott RD, et Walker TJ. 2004. Guide de terrain sur les sauterelles, les katydides et les grillons des États-Unis. Cornell University Press, Ithaque. 249 pp.,
- Chapman RF, Joern A. (éd.) 1990. Biologie des sauterelles. John Wiley, New York.
- Cohn TJ. 1999. Controverses actuelles: stabilité de la nomenclature et loi de priorité. Metaleptea 19: 8-9.
- Griffiths JT, Thompson WL. 1952. Sauterelles dans les plantations d’agrumes. L’université de la Floride Agricultural Experiment Station Bulletin no. 496.
- Helfer JR. 1953. Comment connaître les Sauterelles, les Cafards et Leurs Alliés. WM.C. Brown Société Des Éditeurs. Dubuque, Dans L’Iowa. p. 100-101.
- Hunter-Jones, P. 1967., Le cycle biologique de la sauterelle lubber orientale, Romalea microptera (Beauvois), (Orthoptera: Acrididae) dans des conditions de laboratoire. Proceedings of the Royal Entomological Society, Londres (A) 42: 18-24.
- Johny J, Whitman DW. 2005. Description et biologie de laboratoire de Boliviana floridensisn. sp (Apicomplexa: Eugregarinida) parasitant la sauterelle du homard de l’est,Romalea microptera (Ortoptera: Romalidae) de Floride, États-Unis. Comparatif Parasitologie 72: 150-156, doi: 10.1654/4164.
- Jones CG, Hess TA, Whitman DW, Silk PJ, Blum MS. 1987., Effets de la largeur du régime alimentaire sur la défense chimique autogène d’une sauterelle généraliste. Journal of Chemical Ecology 13: 283-297.
- Jones CG, Whitman DW, Compton SJ, Silk PJ, Blum MS. 1989. La réduction de l’ampleur du régime alimentaire entraîne la séquestration des produits chimiques végétaux et augmente l’efficacité de la défense chimique chez une sauterelle généraliste. Journal of Chemical Ecology 15: 1811-1822.
- Kevan DK McE. 1080. Romalea guttata (Houttuyn), changement de nom pour la célèbre « sauterelle lubber orientale” (Orthoptera: Romaleidae). Entomologique News 91: 139-140.
- Kuitert LC, Connin RV. 1953., Sauterelles et leur contrôle. L’université de la Floride Agricultural Experiment Station Bulletin no. 516.
- Lamb MA, Otto DJ, Whitman DW. 1999. Le parasitisme de l’est de foi sauterelle par Anisia serotina (Diptera: Tachinidae) en Floride. La Floride Entomologiste 82: 365-371.
- Lange CE, Johny S, Baker MD, Whitman DW, Solter LF. 2009. Une nouvelle espèce d’Encephalitozoon (Microsporida) isolée de la sauterelle lubber, Romalea microptera (Beauvois) (Orthoptera: Romaleidae). Journal de parasitologie 95: 976-986.
- Rehn JAG, Grant Jr HJ. 1961., Une monographie des Orthoptères d’Amérique du Nord (Nord du Mexique). Monographies de l’Académie des Sciences Naturelles de Philadelphie. No 12. Vol. 1. p.231-240. Wickersham Imprimerie. Lancaster, Pennsylvanie.
- Squitier JM, Capinera JL. 2002. Sélection des hôtes par des sauterelles (Orthoptera: Acrididae) habitant des milieux semi-aquatiques. La Floride Entomologiste 85: 336-340.
- Stauffer TW, Hegrenes SG, Whitman, DW. 1998. Une étude en laboratoire du site de ponte de préférence dans la foi sauterelle, Romalea guttata (Houttuyn). Journal de Orthoptera de Recherche 7: 217-221.,
- Stauffer TW, Whitman DW. 2007. Divergentes de ponte des comportements dans un désert vs un marais puant. Journal de Orthoptera de la Recherche 16: 103-114.
- Watson JR. 1941. Migrations et préférences alimentaires du criquet lubberly. La Floride Entomologiste 24: 40-42.
- Whitman DW. 1988. Allelochemical interactions entre les plantes, les herbivores et leurs prédateurs, pp. 11-64 Dans Barbosa P et Letournearu D (eds.) Nouveaux aspects des interactions Insectes-Plantes. J. Wiley, New York.
- Whitman DW, Billen JPJ, Alsop D, Blum MS. 1991., Anatomie, ultrastruicture, et de la morphologie fonctionnelle de la metathoracic trachéale glandes défensives de la sauterelle Romalea guttata. Revue canadienne de zoologie 69: 2100-2108.
- Whitman DW, Jones CG, Blum MS. 1992. La défensive de la sécrétion de foi des sauterelles (Orthoptera: Romalidae): influence de l’âge, du sexe, de l’alimentation et de la fréquence de décharge. Annales de la Société entomologique d’Amérique 85: 96-102.
- Yousef R, Whitman D. 1992. Exaptations des prédateurs et adaptations défensives en équilibre évolutif: aucune défense n’est parfaite. L’Écologie Évolutive 6: 527-536.












