Objectifs d’apprentissage
À la fin de cette section, vous pourrez:
- Décrire comment les électrons ont été découverts.
- Expliquer les Millikan goutte d’huile expérience.
- Décrivez l’expérience de la feuille d’or de Rutherford.
- Décrivez le modèle planétaire de l’atome de Rutherford.
Tout comme les atomes sont une sous-structure de la matière, les électrons et les noyaux sont des sous-structures de l’atome., Les expériences qui ont été utilisées pour découvrir les électrons et les noyaux révèlent certaines des propriétés de base des atomes et peuvent être facilement comprises en utilisant des idées telles que la force électrostatique et magnétique, déjà abordées dans les chapitres précédents.
Charges et forces électromagnétiques
Dans les discussions précédentes, nous avons noté que la charge positive est associée aux noyaux et la charge négative aux électrons. Nous avons également couvert de nombreux aspects des forces électriques et magnétiques qui affectent les charges., Nous allons maintenant explorer la découverte de l’électron et du noyau en tant que sous-structures de l’atome et examiner leurs contributions aux propriétés des atomes.
L’Électron

la Figure 1. Un tube à décharge de gaz brille lorsqu’une haute tension lui est appliquée. Les électrons émis par la cathode sont accélérés vers l’anode; ils excitent les atomes et les molécules du gaz, qui brillent en réponse., Autrefois appelés tubes de Geissler et plus tard tubes de Crookes, ils sont maintenant connus sous le nom de tubes cathodiques (CRT) et se trouvent dans les téléviseurs plus anciens, les écrans d’ordinateur et les machines à rayons X. Lorsqu’un champ magnétique est appliqué, le faisceau se plie dans la direction prévue pour la charge négative. (crédit: Paul Downey, Flickr)
Les tubes à décharge de gaz, comme celui représenté sur la figure 1, sont constitués d’un tube de verre évacué contenant deux électrodes métalliques et un gaz raréfié. Lorsqu’une haute tension est appliquée aux électrodes, le gaz brille. Ces tubes ont été les précurseurs des néons d’aujourd’hui., Ils ont d’abord été étudiés sérieusement par Heinrich Geissler, un inventeur allemand et souffleur de verre, à partir des années 1860. Le scientifique anglais William Crookes, entre autres, a continué à étudier ce que pendant un certain temps ont été appelés tubes de Crookes, dans lequel les électrons sont libérés des atomes et des molécules dans le gaz raréfié à l’intérieur du tube et sont accélérés de la cathode (négative) à l’anode (positive) par le potentiel élevé., Ces « rayons cathodiques » entrent en collision avec les atomes et les molécules de gaz et les excitent, entraînant l’émission d’un rayonnement électromagnétique (EM) qui rend le trajet des électrons visible sous la forme d’un rayon qui se propage et s’estompe lorsqu’il s’éloigne de la cathode.
Aujourd’hui, les tubes à décharge de gaz sont le plus souvent appelés tubes cathodiques, car les rayons proviennent de la cathode. Crookes a montré que les électrons portent de l’élan (ils peuvent faire tourner une petite roue à aubes)., Il a également constaté que leur chemin normalement droit est plié par un aimant dans la direction attendue pour une charge négative s’éloignant de la cathode. Ce sont les premières indications directes des électrons et de leur charge.

la Figure 2. J. J. Thomson (crédit: www.firstworldwar.com, via Wikimedia Commons)
Le physicien anglais J. J. Thomson (1856-1940) a amélioré et élargi la portée des expériences avec des tubes à décharge. (Voir la Figure 2 et la Figure 3.,) Il a vérifié la charge négative des rayons cathodiques avec des champs magnétiques et électriques. De plus, il a recueilli les rayons dans une tasse en métal et a trouvé un excès de charge négative. Thomson a également pu mesurer le rapport de la charge de l’électron à sa masse, \frac{q_e}{m_e}\\—une étape importante pour trouver les valeurs réelles de qe et me. La figure 4 montre un tube cathodique, qui produit un faisceau étroit d’électrons qui traverse des plaques de charge connectées à une alimentation haute tension., Un champ électrique E est produite entre le chargement des plaques, et le tube cathodique est placé entre les pôles d’un aimant, de sorte que le champ électrique E est perpendiculaire au champ magnétique B de l’aimant. Ces champs, étant perpendiculaires les uns aux autres, produisent des forces opposées sur les électrons. Comme discuté pour les spectromètres de masse dans plus d’applications du magnétisme, si la force nette due aux champs disparaît, alors la vitesse de la particule chargée est v=\frac{E}{B}\\., De cette manière, Thomson a déterminé la vitesse des électrons, puis a déplacé le faisceau de haut en bas en ajustant le champ électrique.

la Figure 3. Diagramme du tube cathodique de Thomson. (crédit: Kurzon, Wikimedia Commons)

la Figure 4. Ce schéma montre le faisceau d’électrons dans un tube cathodique traversant des champs électriques et magnétiques croisés et faisant briller le phosphore lorsqu’il frappe l’extrémité du tube.
En rassemblant les termes, nous avons \frac{q_e}{m_e}=\frac{a}{E}\\.,
Qu’est-ce qui est si important dans \frac{q_e}{m_e}\\, le rapport entre la charge de l’électron et sa masse? La valeur obtenue est
\displaystyle\frac{q_e}{m_e}=-1.76\times10^{11}\text{ C/kg (électron)}\\
C’est un grand nombre, comme Thomson réalisé, et il implique que l’électron a une très faible masse. On savait par galvanoplastie qu’environ 108 C / kg sont nécessaires pour plaquer un matériau, un facteur d’environ 1000 inférieur à la charge par kilogramme d’électrons., Thomson a continué à faire la même expérience pour les ions hydrogène chargés positivement (maintenant connus pour être des protons nus) et a trouvé une charge par kilogramme environ 1000 fois plus petite que celle de l’électron, ce qui implique que le proton est environ 1000 fois plus massif que l’électron. Aujourd’hui, on sait plus précisément que
\displaystyle\frac{q_p}{m_p}=9.58\times10^{7}\text{ C/kg (proton)}\\,
où qp est la charge du proton et mp sa masse. Ce rapport (à quatre chiffres significatifs) est 1836 fois moins de charge par kilogramme que pour l’électron., Puisque les charges des électrons et des protons sont égales en magnitude, cela implique mp = 1836me.
Thomson a effectué une variété d’expériences en utilisant différents gaz dans des tubes à décharge et en utilisant d’autres méthodes, telles que l’effet photoélectrique, pour libérer les électrons des atomes. Il a toujours trouvé les mêmes propriétés pour l’électron, prouvant qu’il s’agissait d’une particule indépendante. Pour son travail, dont il a commencé à publier les pièces importantes en 1897, Thomson a reçu le prix Nobel de physique de 1906., Rétrospectivement, il est difficile de comprendre comment étonnant de découvrir que l’atome a une sous-structure. Thomson lui-même a déclaré: « Ce n’est que lorsque j’ai été convaincu que l’expérience n’y échappait pas que j’ai publié ma croyance en l’existence de corps plus petits que les atomes. »
Thomson a tenté de mesurer la charge d’électrons individuels, mais sa méthode n’a pu déterminer sa charge qu’à l’ordre de grandeur attendu.
Depuis les expériences de Faraday sur la galvanoplastie dans les années 1830, on savait qu’environ 100 000 C par mole étaient nécessaires pour plaquer des ions ionisés individuellement., En divisant cela par le nombre d’ions par mole (c’est-à-dire par le nombre d’Avogadro), qui était approximativement connu, la charge par ion a été calculée pour être d’environ 1,6 × 10-19 C, proche de la valeur réelle.

la Figure 5. Robert Millikan (crédit: Auteur inconnu, via Wikimedia Commons)
Un physicien américain, Robert Millikan (1868-1953) (voir Figure 5), a décidé d’améliorer l’expérience de Thomson pour mesurer le qe et a finalement été contraint d’essayer une autre approche, qui est maintenant une expérience classique réalisée par des étudiants., L’expérience Millikan oil drop est illustrée à la figure 6.
Dans l’expérience Millikan oil drop, de fines gouttes d’huile sont pulvérisées à partir d’un atomiseur. Certains d’entre eux sont chargés par le procédé et peuvent ensuite être suspendus entre des plaques métalliques par une tension entre les plaques. Dans cette situation, le poids de la goutte est équilibrée par la force électrique:
m dropg = qe E

la Figure 6., L’expérience Millikan oil drop a produit la première mesure directe précise de la charge sur les électrons, l’une des constantes les plus fondamentales de la nature. De fines gouttes d’huile se chargent lorsqu’elles sont pulvérisées. Leur mouvement est observé entre des plaques métalliques avec un potentiel appliqué pour s’opposer à la force gravitationnelle. L’équilibre des forces gravitationnelles et électriques permet le calcul de la charge sur une goutte. On trouve que la charge est quantifiée en unités de -1,6 × 10-19 C, déterminant ainsi directement la charge des électrons en excès et manquants sur les gouttes d’huile.,
Le champ électrique est produit par la tension appliquée, par conséquent, E=\frac{V}{d}\\, et V est ajusté pour équilibrer le poids de la goutte. Les gouttes peuvent être vues comme des points de lumière réfléchie à l’aide d’un microscope, mais elles sont trop petites pour mesurer directement leur taille et leur masse. La masse de la goutte est déterminée en observant à quelle vitesse elle tombe lorsque la tension est éteinte. Étant donné que la résistance de l’air est très importante pour ces gouttes submicroscopiques, les gouttes les plus massives tombent plus vite que les moins massives, et des calculs de sédimentation sophistiqués peuvent révéler leur masse., L’huile est utilisée plutôt que l’eau, car elle ne s’évapore pas facilement et la masse est donc presque constante. Une fois la masse de la goutte est connu, la charge de l’électron est donnée par la réorganisation de la précédente équation:
\displaystyle{q}=\frac{m_{\text{drop}}g}{E}=\frac{m_{\text{drop}}gd}{V}\\,
où d est la séparation des plaques et V est la tension qui détient la goutte immobile. (La même goutte peut être observée pendant plusieurs heures pour voir qu’elle est vraiment immobile.,) En 1913, Millikan avait mesuré la charge de l’électron qe avec une précision de 1%, et il l’a améliorée d’un facteur 10 en quelques années pour atteindre une valeur de -1,60 × 10-19 C. Il a également observé que toutes les charges étaient des multiples de la charge électronique de base et que des changements soudains pouvaient Pour cette mesure directe très fondamentale du qe et pour ses études de l’effet photoélectrique, Millikan a reçu le prix Nobel de physique de 1923.,
Avec la charge de l’électron connue et de la charge massique connue, l’électron de masse peut être calculée. C’est
\displaystyle{m}=\frac{q_e}{\left(\frac{q_e}{m_e}\right)}\\
en Substituant les valeurs connues des rendements
\displaystyle{m}_e=\frac{-1.60\times10^{-19}\text{ C}}{-1.76\times10^{11}\text{ C/kg}}\\
ou moi = 9.11 × 10-31 kg (de l’électron de masse), où l’arrondi des erreurs ont été corrigées., La masse de l’électron a été vérifiée dans de nombreuses expériences ultérieures et est maintenant connue avec une précision supérieure à une partie sur un million. C’est une masse incroyablement petite et reste la plus petite masse connue de toute particule qui a une masse. (Certaines particules, telles que les photons, sont sans masse et ne peuvent pas être mises au repos, mais voyagent à la vitesse de la lumière.) Un calcul similaire donne les masses d’autres particules, y compris le proton. À trois chiffres, la masse du proton est maintenant connu pour être mp = 1.67 × 10-27 kg de protons (de masse), qui est presque identique à la masse d’un atome d’hydrogène., Ce que Thomson et Millikan n’ont fait que prouver l’existence d’une sous-structure de l’atome, l’électron, et pour montrer qu’il avait seulement une petite fraction de la masse d’un atome. Le noyau d’un atome contient la majeure partie de sa masse, et la nature du noyau était complètement imprévue.
Une autre caractéristique importante de la mécanique quantique commençait également à émerger. Tous les électrons sont identiques les uns aux autres. La charge et la masse des électrons ne sont pas des valeurs moyennes; ce sont plutôt des valeurs uniques que tous les électrons ont., Cela est vrai pour d’autres entités fondamentales au niveau submicroscopique. Tous les protons sont identiques les uns aux autres, et ainsi de suite.
Le Noyau
Ici, nous examinons la première preuve directe de la taille et de la masse du noyau. Dans les chapitres suivants, nous examinerons de nombreux autres aspects de la physique nucléaire, mais les informations de base sur la taille et la masse nucléaires sont si importantes pour comprendre l’atome que nous le considérons ici.
La radioactivité nucléaire a été découverte en 1896, et elle a bientôt fait l’objet d’une étude intense par un certain nombre des meilleurs scientifiques du monde., Parmi eux se trouvait le Néo-zélandais Lord Ernest Rutherford, qui a fait de nombreuses découvertes fondamentales et a gagné le titre de « père de la physique nucléaire. »Né à Nelson, Rutherford a fait ses études supérieures aux Laboratoires Cavendish en Angleterre avant d’occuper un poste à l’Université McGill au Canada où il a fait les travaux qui lui ont valu un prix Nobel de chimie en 1908. Dans le domaine de la physique atomique et nucléaire, il y a beaucoup de chevauchement entre la chimie et la physique, la physique fournissant les théories fondamentales habilitantes., Il est retourné en Angleterre dans les années suivantes et a eu six futurs lauréats du prix Nobel comme étudiants. Rutherford radiations nucléaires d’examiner directement la taille et la masse du noyau atomique. L’expérience qu’il a conçue est illustrée à la figure 7. Une source radioactive qui émet un rayonnement alpha a été placé dans une récipient avec un trou sur le côté pour produire un faisceau de particules alpha, qui sont un type de rayonnement ionisant éjecté par les noyaux d’une source radioactive., Une fine feuille d’or a été placée dans le faisceau et la diffusion des particules alpha a été observée par la lueur qu’elles provoquaient lorsqu’elles frappaient un écran de phosphore.

la Figure 5. L’expérience de Rutherford a donné des preuves directes de la taille et de la masse du noyau en diffusant des particules alpha à partir d’une fine feuille d’or. Les particules alpha avec des énergies d’environ 5MeV sont émises par une source radioactive (qui est un petit récipient métallique dans lequel une quantité spécifique d’une matière radioactive est scellée), sont collimées dans un faisceau et tombent sur la feuille., Le nombre de particules qui pénètrent dans la feuille ou se dispersent sous différents angles indique que les noyaux d’or sont très petits et contiennent presque toute la masse de l’atome d’or. Ceci est particulièrement indiqué par les particules alpha qui se dispersent dans de très grands angles, un peu comme un ballon de football rebondissant sur la tête d’un gardien de but.,
Les particules alpha étaient connues pour être les noyaux positifs doublement chargés des atomes d’hélium qui avaient des énergies cinétiques de l’ordre de 5 MeV lorsqu’ils étaient émis dans la désintégration nucléaire, qui est la désintégration du noyau d’un nucléide instable par l’émission spontanée de particules chargées. Ces particules interagissent avec la matière principalement par la force de Coulomb, et la manière dont elles se dispersent à partir des noyaux peut révéler la taille et la masse nucléaires. Ceci est analogue à observer comment une boule de bowling est dispersée par un objet que vous ne pouvez pas voir directement., Parce que l’énergie de la particule alpha est si grande par rapport aux énergies typiques associées aux atomes (MeV contre eV), vous vous attendez à ce que les particules alpha s’écrasent simplement à travers une feuille mince, tout comme une boule de bowling supersonique s’écraserait à travers quelques dizaines de rangées de quilles. Thomson avait envisagé l’atome comme une petite sphère dans laquelle des quantités égales de charge positive et négative étaient réparties uniformément. Les particules alpha massives incidentes ne subiraient que de petites déviations dans un tel modèle., Au lieu de cela, Rutherford et ses collaborateurs ont constaté que les particules alpha étaient parfois dispersées à de grands angles, certains même dans la direction d’où elles venaient! Une analyse détaillée utilisant la conservation de l’élan et de l’énergie—en particulier du petit nombre qui est revenu directement—impliquait que les noyaux d’or sont très petits par rapport à la taille d’un atome d’or, contiennent presque toute la masse de l’atome et sont étroitement liés. Puisque le noyau d’or est plusieurs fois plus massif que la particule alpha, une collision frontale disperserait la particule alpha directement vers la source., De plus, plus le noyau est petit, moins il y a de particules alpha qui frapperaient une tête.
Bien que les résultats de l’expérience aient été publiés par ses collègues en 1909, Rutherford a mis deux ans à se convaincre de leur signification. Comme Thomson avant lui, Rutherford était réticent à accepter des résultats aussi radicaux. La nature à petite échelle est tellement différente de notre monde classique que même ceux qui sont à la pointe de la découverte sont parfois surpris. Rutherford a écrit plus tard: « C’était presque aussi incroyable que si vous tiriez une coquille de 15 pouces sur un morceau de papier de soie et qu’elle revenait et vous frappait., Sur la considération, je me suis rendu compte que cette dispersion vers l’arrière . . . . . . la plus grande partie de la masse de l’atome est concentrée dans un petit noyau. »
En 1911, Rutherford a publié son analyse avec un modèle proposé de l’atome. La taille du noyau a été déterminée comme étant d’environ 10-15 m, soit 100 000 fois plus petite que l’atome. Cela implique une densité énorme, de l’ordre de 1015 g/cm3, très différente de toute matière macroscopique. L’existence de forces nucléaires auparavant inconnues pour contrer les énormes forces répulsives de Coulomb parmi les charges positives dans le noyau est également implicite., Des forces énormes seraient également compatibles avec les grandes énergies émises dans le rayonnement nucléaire.

la Figure 8. Une vision élargie des atomes dans la feuille d’or dans l’expérience de Rutherford. Les cercles représentent les atomes (environ 10-10 m de diamètre), tandis que les points représentent le noyau (10-15 m de diamètre). Pour être visibles, les points sont beaucoup plus grands que l’échelle. La plupart des particules alpha s’écrasent mais sont relativement inchangées en raison de leur énergie élevée et de la faible masse de l’électron., Certains, cependant, se dirigent droit vers un noyau et sont dispersés en arrière. Une analyse détaillée donne la taille et la masse du noyau.
La petite taille du noyau implique aussi que l’atome est vide à l’intérieur. En fait, dans l’expérience de Rutherford, la plupart des alphas sont passés directement à travers la feuille d’or avec très peu de diffusion, puisque les électrons ont de si petites masses et que l’atome était principalement vide sans rien pour que l’alpha frappe., Il y avait déjà des indices de cela au moment où Rutherford a effectué ses expériences, puisque les électrons énergétiques avaient été observés pour pénétrer les feuilles minces plus facilement que prévu. La figure 8 montre un schéma des atomes dans une feuille mince avec des cercles représentant la taille des atomes (environ 10-10 m) et des points représentant les noyaux. (Les points ne sont pas à l’échelle—si elles l’étaient, vous auriez besoin d’un microscope pour les voir.) La plupart des particules alpha manquent les petits noyaux et ne sont que légèrement dispersées par les électrons., De temps en temps, (environ une fois sur 8000 dans l’expérience de Rutherford), un alpha frappe un noyau de front et est dispersé droit vers l’arrière.

la Figure 9. Le modèle planétaire de Rutherford de l’atome incorpore les caractéristiques du noyau, des électrons et de la taille de l’atome. Ce modèle a été le premier à reconnaître la structure des atomes, dans laquelle les électrons de faible masse orbitent autour d’un très petit noyau massif sur des orbites beaucoup plus grandes que le noyau. L’atome est en grande partie vide et est analogue à notre système planétaire.,
Sur la base de la taille et de la masse du noyau révélée par son expérience, ainsi que de la masse des électrons, Rutherford a proposé le modèle planétaire de l’atome. Le modèle planétaire de l’atome montre des électrons de faible masse en orbite autour d’un noyau de grande masse. Les tailles des orbites d’électrons sont grandes par rapport à la taille du noyau, avec principalement du vide à l’intérieur de l’atome. Cette image est analogue à la façon dont les planètes de faible masse dans notre système solaire orbitent autour du Soleil de grande masse à des distances importantes par rapport à la taille du soleil., Dans l’atome, la force de Coulomb attrayante est analogue à la gravitation dans le système planétaire. (Voir La Figure 9.) Notez qu’un modèle ou une image mentale est nécessaire pour expliquer les résultats expérimentaux, car l’atome est trop petit pour être observé directement avec la lumière visible.
Le modèle planétaire de l’atome de Rutherford était crucial pour comprendre les caractéristiques des atomes, leurs interactions et leurs énergies, comme nous le verrons dans les sections suivantes. En outre, il était une indication de la façon dont la nature est différente du monde classique familier sur la petite échelle mécanique quantique., La découverte d’une sous-structure de toute la matière sous la forme d’atomes et de molécules était maintenant prise une étape plus loin pour révéler une sous-structure d’atomes qui était plus simple que les 92 éléments alors connus. Nous avons continué à rechercher des sous-structures plus profondes, telles que celles à l’intérieur du noyau, avec un certain succès. Dans les chapitres suivants, nous suivrons cette quête dans la discussion des quarks et autres particules élémentaires, et nous examinerons la direction que la recherche semble maintenant prendre.,
Phet Explorations: Rutherford Scattering
Comment Rutherford a-t-il compris la structure de l’atome sans pouvoir le voir? Simuler la célèbre expérience dans laquelle il a réfuté le modèle de Plum Pudding de l’atome en observant les particules alpha rebondissant sur les atomes et en déterminant qu’ils doivent avoir un petit noyau.
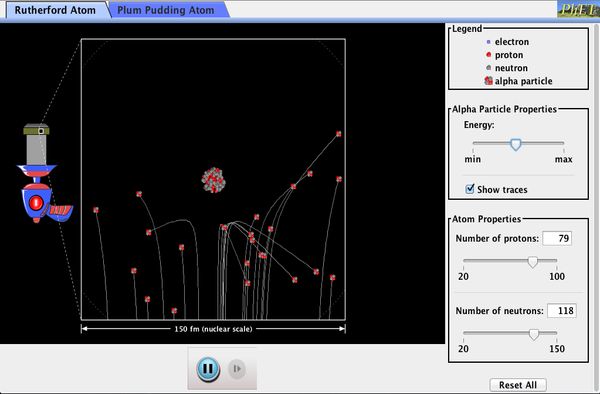
Cliquez ici pour télécharger la simulation. Exécuter en utilisant Java.,
Résumé de la section
Problèmes& Exercices
- Rutherford a trouvé que la taille du noyau était d’environ 10-15 m. Cela impliquait une densité énorme. Et quelle serait cette densité de l’or?
- Dans l’expérience oil-drop de Millikan, on regarde une petite goutte d’huile immobile entre deux plaques. Prenez la tension entre les plaques à 2033 V, et la séparation des plaques à 2,00 cm. La goutte d’huile (de densité 0,81 g/cm3) a un diamètre de 4,0 × 10-6 m. Trouvez la charge sur la goutte, en termes d’unités d’électrons. ,
- (a) Une physicienne en herbe veut construire une maquette d’un atome d’hydrogène pour son projet d’expo-sciences. Si l’atome fait 1,00 m de diamètre, quelle taille devrait-elle essayer de faire le noyau? b) Dans quelle mesure cela sera-t-il facile à faire?