1Introduction
L’infection chronique active par le virus d’Epstein-Barr (VEBAE) est un terme clinique initialement défini par Straus comme une maladie liée à une infection chronique ou persistante du VEB., Les critères suggérés pour diagnostiquer une infection chronique sévère par le VEB comprennent les suivants: 1) maladie grave de >Durée de 6 mois qui a commencé comme infection primaire par le VEB et est associée à des titres d’anticorps EBV anormaux ; (2) augmentation des quantités d’ADN EBV ou des niveaux anormaux d’anticorps EBV, par exemple, détection de l’ADN EBV dans les tissus ou le sang périphérique par hybridation Southern blot; petites cellules positives à ARN-1 codées par le VEB dans les tissus affectés ou le sang périphérique, >102.,5 copies d’ADN EBV / µg d’ADN de cellules mononucléaires du sang périphérique; et des niveaux anormaux flagrants d’anticorps EBV (titres IgG anti-VCA ≥5120 ou titres IgG anti-EA ≥640), et (3) aucune preuve d’anomalies immunologiques antérieures ou d’une autre infection récente pouvant expliquer la condition observée.,4
Sur la base des données accumulées, le VSEE de type T ou NK a été récemment défini comme un trouble lymphoprolifératif systémique EBV+ polyclonal, oligoclonal ou souvent monoclonal (LPD) caractérisé par de la fièvre, une hépatite persistante, une hépatosplénomégalie et une lymphadénopathie, dont la gravité clinique varie en fonction de la réponse immunitaire de l’hôte et de la charge virale EBV.5,6
Le VSEE est souvent accompagné de lésions cutanées telles qu’une allergie sévère aux piqûres de moustiques et une maladie lymphoproliférative à cellules T de type hydroa-vacciniforme (HV)., L’hypersensibilité aux piqûres de moustiques (ou allergie aux piqûres de moustiques, MBH) est une manifestation cutanée unique de l’infection par le VCEE caractérisée par une réaction locale anormalement intense au niveau de la zone de piqûre d’arthropode associée à des symptômes et des signes systémiques tels que fièvre, adénopathie et dysfonctionnement hépatique. Le génome EBV se trouve principalement dans les cellules NK du sang périphérique des patients MBH qui présentent souvent une lymphocytose des cellules NK.,7-10
La LPD de type HV est une maladie lymphoproliférative cutanée polyclonale, oligoclonale ou monoclonale associée à l’EBV caractérisée par des éruptions vésiculopapulaires récurrentes, principalement sur le visage et les bras. Il montre un large spectre d’agressivité clinique et généralement une longue évolution clinique avec risque de développer un lymphome systémique. Au fur et à mesure que la maladie progresse, les patients développent des lésions cutanées graves et étendues avec des symptômes systémiques tels que fièvre, hépatosplénomégalie et lymphadénopathie., Le HV classique, le HV sévère et le lymphome à cellules T de type HV constituent un spectre continu de DPL de type HV associé à l’EBV.5,11-14
Récemment, les trois troubles indiqués ci-dessus ont été reconnus comme représentant le spectre des lymphocytes T associés à l’EBV et des lymphocytes NK avec des présentations cliniques différentes; un trouble systémique et deux troubles cutanés, y compris les lymphocytes T de type HV LPD et MBH.14
2déclarations de cas
Les patients décrits dans les deux rapports de cas suivants décrivent des manifestations cliniques typiques de la VCEE avec MBH chez les enfants. Le cas 2 a déjà été signalé.15
2.,1CAS 1
Un garçon coréen de 15 ans a été admis à l’hôpital avec des symptômes et des signes dermatologiques intermittents chroniques et divers symptômes systémiques depuis l’âge de 5 ans. Le poids à la naissance était normal et adéquat pour l’âge gestationnel. Lors d’une récente visite dans un service de pédiatrie, il a montré une taille adéquate de 163,7 cm pour son âge, mais un faible poids corporel de 39,6 kg.
À l’âge de 5 ans, de la fièvre, de la toux et une distension abdominale se sont soudainement développées. Le nombre de globules blancs était de 12,1 × 103/µl (lymphocytes 70%, neutrophiles segmentés 21%, éosinophiles 1% et monocytes 8%)., L’anticorps antinucléaire fluorescent qualitatif était négatif. À la suite d’un diagnostic clinique de perforation intestinale, il a subi une colectomie sous-totale et une iléostomie. Un mois après la chirurgie, le nombre de sous – ensembles lymphocytaires par cytométrie en flux a montré un faible nombre de cellules B et T, avec une augmentation marquée des cellules NK (CD16 + CD56+ = 68%, plage normale 5,6-31%); 1 579/µl (plage normale 100-430/µl).,
Il a par la suite été hospitalisé cinq fois en 3 ans en raison d’une pharyngotonsillite aiguë, d’une infection des voies respiratoires supérieures, d’une bronchiolite et d’une pneumonie et a connu une fièvre récurrente deux ou trois fois par mois. À 10 ans, il a été hospitalisé en raison d’une infection des voies respiratoires supérieures. Une splénomégalie de 10,76 cm a été trouvée incidemment pendant le travail. À partir de l’âge de 10 ans, des réponses cutanées intenses se sont manifestées sur les sites piqués par des moustiques ou d’autres insectes, caractérisées par un changement bulleux initial suivi d’ulcération, de formation de croûte et de cicatrices avec pigmentation (Fig. 1)., La plupart des lésions mesuraient
cm de diamètre et étaient fréquemment accompagnées de fièvre. Ces lésions cutanées avaient tendance à se produire en été et sur les membres supérieurs et inférieurs. Les tests de laboratoire effectués au moment de l’allergie sévère aux piqûres de moustiques ont montré une légère élévation de l’aspartate transaminase/alanine transaminase (ASAT/ALT) avec une élévation significative de la phosphatase alcaline (200U/l) et de la globine (4,5 à 4,8 g/dl).
Une biopsie cutanée obtenue à partir d’une lésion a été signalée comme indiquant une possibilité de syndrome de Sweet. Échographie abdominale a indiqué une splénomégalie., Les nombres différentiels de sang périphérique ont montré de faibles populations de cellules B et T et une lymphocytose à cellules NK . Le taux sérique d’gE a été augmenté à 20 370 U/ml, bien qu’aucune réponse spécifique à divers stimuli allergènes n’ait été identifiée. Malgré l’absence d’antécédents familiaux prouvés, une impression clinique de syndrome hyper -gE a été faite comme premier diagnostic différentiel. Une étude génétique incluant le séquençage de STAT3 a été réalisée mais n’a pas permis de trouver la mutation attendue., Lors de l’examen de l’évolution clinique et de la lymphocytose NK, la maladie lymphoproliférative associée à la VCEE ou au VEB a été considérée comme d’autres diagnostics différentiels et des tests pertinents ont été établis.
Les tests sérologiques ont montré la positivité de l’EBV VCA-IgG, l’antigène EBV-early et la négativité de l’EBV VCA IgM. À l’aide d’un échantillon de sang total, une PCR quantitative en temps réel de l’ADN du VEB a été réalisée pour déterminer la charge virale dans le sang (11 450 copies/5µl de sang total). Par la suite, il a subi un examen régulier du nombre de copies du génome viral, qui s’est avéré être constamment élevé, allant de 212.,5 copies / µl à 1 562 copies/µl de sang total. Son problème de peau associé aux moustiques ou aux insectes s’était produit par intermittence depuis, tandis que des épisodes intermittents de maladie fébrile dépourvus de lésion cutanée avaient également persisté. Le problème de peau non spécifique a persisté pendant 15 mois. L’examen physique a révélé des taches écailleuses érythémateuses à brunâtres avec des croûtes jaunâtres sur le visage, le cou, le cuir chevelu, le haut de la poitrine et le haut du dos. Il a été traité avec des stéroïdes topiques et des antihistaminiques oraux sous impression de dermatite séborrhéique pendant 11 mois (Fig. 1)., Deux mois avant l’examen, ses symptômes se sont aggravés et il a visité une clinique de dermatologie. Deux biopsies cutanées de son visage et de son cou ont été prélevées et une hybridation in situ de l’EBV a été réalisée. Les biopsies ont montré une augmentation des cellules lymphoplasmiques dans le derme superficiel et profond avec une distribution périadnexale occasionnelle. Il n’y avait pas d’atypie claire dans la plupart des cellules lymphoïdes. L’immunohistochimie a montré de nombreuses cellules lymphoïdes CD56+. De nombreux lymphocytes ont montré une réaction nucléaire positive à l’hybridation in situ d’EBER., Rétrospectivement, l’hybridation in situ EBER a été appliquée à la fois à la biopsie cutanée de la jambe inférieure prise pour une allergie sévère aux piqûres de moustiques et à celle de l’intestin perforé réséqué il y a 10 ans (Fig. 2). De nombreuses cellules lymphoïdes présentant une réaction positive ont été identifiées, non seulement dans la peau, mais également dans la paroi intestinale et les sinusoïdes du foie et des ganglions lymphatiques, ce qui a confirmé l’infection par le VCEE avec allergie aux piqûres de moustiques et lymphocytose NK. Le patient a été traité de manière conservatrice. Deux ans plus tard, il a été réadmis en raison d’une lymphohistiocytose hémophagocytaire (HLH)., Il a été traité selon le guide de traitement HLH-200416 et a répondu de manière transitoire, mais a ensuite développé une perforation intestinale et est décédé d’une septicémie.
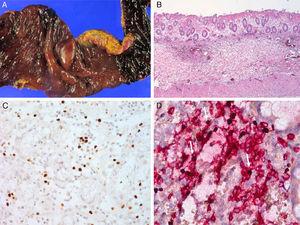
Cas 1. A) Côlon perforé à 5 ans. B) Les résultats microscopiques montrent une inflammation aiguë et chronique du tissu de granulation. (C) L’hybridation in situ d’EBER révèle des lymphocytes EBV-positifs. (D) Les lymphocytes EBV-positifs sont positifs pour CD3.
2.,2CAS 2
Un garçon coréen de 10 ans s’est présenté au Département de dermatologie se plaignant de réactions cutanées intenses sur les sites de piqûres de moustiques. Il a présenté de multiples ulcérations éparses et ponctuées sur les membres inférieurs bilatéraux. En plus de la réaction cutanée marquée, il a également approuvé des symptômes systémiques, y compris de la fièvre suite à des piqûres d’insectes tout au long de son enfance. Une biopsie cutanée a été effectuée et un traitement local de la lésion a été administré sans autre évaluation systémique. À 16 ans, le patient admis avec une masse palpable située sur le cou gauche de 2-3 semaines., À l’examen physique, un conglomérat de gros ganglions lymphatiques était présent dans le cou gauche, dont le plus grand mesurait 7 × 5 cm. En raison de ses antécédents de lésions cutanées, une inspection minutieuse de ses jambes a été effectuée, révélant de multiples ulcères peu profonds avec des cicatrices cicatrisantes. La tomodensitométrie et la tomographie par émission de positons ont montré de multiples ganglions lymphatiques homogènes de taille variable et de faible amélioration impliquant la région cervicale gauche et les zones inguinales bilatérales., De plus, des lésions multifocales ont montré une augmentation de l’absorption du 2-désoxy-2 – fluoro-D-glucose dans la peau et la couche sous-cutanée des joues et des fesses bilatérales. Lors de l’examen hématologique, le nombre de cellules sanguines et le taux d’acide lactique déshydrogénase étaient dans les limites normales. Les IgG anti-VCA, les IgG anti-EA et anti-EBNA étaient positives et les IgM anti-VCA étaient négatives. Le nombre de copies d’ADN EBV était de 529,8 copies / µl de sang total.,
Une biopsie des ganglions lymphatiques a été réalisée révélant un élargissement du paracortex avec infiltration de cellules inflammatoires hétérogènes comprenant de petits lymphocytes, des histiocytes et de nombreux éosinophiles. L’infiltrat inflammatoire était ponctué de grandes cellules atypiques mononucléaires ou multinucléaires dispersées de type Reed-Sternberg (RS), qui avaient de grands nucléoles éosinophiles et une membrane nucléaire épaisse., En utilisant une étude immunohistochimique, les cellules de type RS ont démontré une forte coloration membraneuse pour CD30 et une coloration périnucléaire pour CD15 et ont été positives pour PAX-5 et LMP-1, mais négatives pour CD20, CD3 et EBNA-2. Les cellules mononucléaires et multinucléaires atypiques de type RS ont montré un signal positif par hybridation in situ d’EBER. Mis à part les cellules de type RS, de nombreux petits lymphocytes dispersés en arrière-plan ont également été positifs pour l’hybridation in situ d’EBER. Aucun résultat anormal n’a été observé lors de la biopsie de la moelle osseuse, à l’exception de quelques petits lymphocytes EBV positifs., La biopsie cutanée de la région d’allergie aux piqûres de moustiques en 2002 a été revue rétrospectivement, révélant une nécrose sévère de l’épiderme et du derme supérieur. Il y avait infiltration de petits lymphocytes, histiocytes et de nombreux éosinophiles autour des vaisseaux sanguins et des follicules pileux et les lumières des vaisseaux sanguins étaient souvent oblitérées par les globules rouges et la fibrine. L’analyse immunohistochimique a révélé que les cellules infiltrantes étaient hétérogènes dans leur lignée; certaines étaient positives pour les lymphocytes T CD3 et CD4 ou CD8 auxiliaires ou cytotoxiques, tandis que d’autres étaient positives pour les lymphocytes NK CD56., De nombreuses cellules EBV-positives ont été documentées par hybridation in situ d’EBER. Le diagnostic d’infection chronique active par EBV avec hypersensibilité par piqûre de moustique et lymphoprolifération polymorphe simulant le lymphome de Hodgkin a été posé. Le patient a été traité par ABVD (Adriamycine, Bléomycine, Vinblastin et Dacarbazine) pendant six cycles avec rémission complète. Actuellement, il reste indemne de maladie pendant 7 ans après le traitement.,
3Discussion
L’évolution clinique des patients atteints du VSEE dépend de l’équilibre entre les facteurs liés au VEB et la fonction immunitaire de l’hôte et peut être fumante, progressive ou agressive. Certains patients développent un lymphome/leucémie à cellules EBV+ T/NK.4,17 De 1998 à 2014, 13 patients âgés de 10 à 58 ans (âge médian 22 ans, neuf hommes et quatre femmes) ont été diagnostiqués avec la maladie CAEBV au Samsung Medical Center, en Corée (tableau 1). Les résultats cliniques courants comprenaient la fièvre (13/13), l’hépatosplénomégalie (9/12), l’adénopathie (7/11), la lymphocytose NK (3/4), l’HBM (4/13) et la DPL de type HV (2/13)., Certains patients présentaient une perforation intestinale, une chorée ou un infarctus cérébral. Au cours du suivi médian de 36 mois, sept patients (54%) sont décédés de la maladie, deux patients (15%) présentaient une maladie persistante et deux patients (17%) étaient indemnes de maladie. Deux patients ont été perdus pour le suivi. Les causes de décès étaient le syndrome hémophagocytaire et l’insuffisance organique chez quatre patients, un lymphome à cellules T EBV positif chez un patient et une leucémie agressive à cellules NK chez un patient. La lymphoprolifération de la lignée B imitant le lymphome de Hodgkin observé dans le cas 2 est rare mais a déjà été rapportée.,18
L’infection par le VSEE s’accompagne presque toujours de divers degrés de lymphoprolifération. La clonalité des EBV et des cellules T ou NK infectées par EBV varie et peut être polyclonale, oligoclonale ou monoclonale. À mesure que la maladie progresse de la lymphoprolifération polyclonale à la maladie monoclonale, l’atypie histologique augmente. Ohshima et coll. proposé la catégorisation de CAEBV en trois groupes-polymorphe et polyclonal, polymorphe et monoclonal, ou monomorphe et monoclonal-basé sur la clonalité et les changements histologiques.19 Dans la série rapportée par Ohshima et coll.,, 8/48 patients infectés par le VSEE étaient polyclonaux pour le réarrangement du gène TCR et les cellules infiltrées présentaient une histomorphologie polymorphe; 15 patients présentaient une morphologie polymorphe et un réarrangement du gène TCR biclonal ou monoclonal; et 25 patients présentaient une histomorphologie monomorphe et un réarrangement du gène TCR monoclonal. Les patients atteints du type monomorphe et monoclonal d’infection par le VSEE avaient des pronostics plus faibles que ceux atteints d’une maladie polyclonale polymorphe ou d’une maladie monoclonale polymorphe. La survie des groupes polymorphes/polyclonaux et polymorphes/monoclonaux ne diffère pas significativement., Groupes monomorphes / monoclonaux de CAEBV par Ohshima et al. peut correspondre à la LPD systémique des lymphocytes T selon la classification OMS de 2008.20
En résumé, le VSEE est une DPL rare associée au VEB, principalement de lignée de cellules T ou de cellules NK, avec un large spectre de présentation clinique. La reconnaissance de la maladie est importante pour une prise en charge adéquate du patient. L’analyse du VEB par PCR en temps réel d’un échantillon de sang ou l’hybridation in situ du VEB dans le tissu affecté est importante pour éviter de négliger ces patients et doit être incluse dans les principaux tests diagnostiques pour les enfants fébriles.,
Divulgation éthique
Protection des sujets humains et animaux. Les auteurs déclarent qu’aucune expérience n’a été réalisée sur des humains ou des animaux pour cette étude.
la Confidentialité des données. Les auteurs déclarent avoir suivi les protocoles de leur centre de travail sur la publication des données des patients.
Droit à la vie privée et au consentement éclairé. Les auteurs déclarent qu’aucune donnée patient n’apparaît dans cet article.
Conflit d’intérêts
Les auteurs ne déclarent aucun conflit d’intérêts de quelque nature que ce soit.