US Pharm. 2020;45(9):27-29.
RÉSUMÉ: Depuis que les hormones synthétiques ont été combinées pour la première fois dans les années 1940, l’hormonothérapie substitutive a été largement utilisée par les femmes présentant des symptômes ménopausiques indésirables. Des recherches ultérieures ont mené à la découverte de plusieurs effets négatifs associés à l’utilisation de l’hormonothérapie, suscitant des discussions sur les risques par rapport aux avantages du traitement hormonal., En raison des risques associés aux préparations commerciales, l’hormonothérapie composée (CHT) est devenue plus importante, car elle a été présentée comme une alternative biologiquement équivalente aux hormones synthétiques. Cependant, en raison d’une surveillance minimale ou nulle de la FDA dans le domaine de la composition en général, le CHT peut ne pas être aussi sûr que ce qui a été annoncé. En 2018, sur la base de résultats d’essai favorables, Bijuva est devenue la première formulation bioidentical de combinaison 17-beta estradiol-progestérone approuvée par la FDA.,
Pendant des décennies, les femmes se sont tournées vers l’hormonothérapie substitutive pour traiter les symptômes vasomoteurs indésirables associés à la ménopause, tels que les bouffées de chaleur et les sueurs nocturnes. Les femmes peuvent passer jusqu’à un tiers de leur vie dans un état déficient en hormones, ce qui contribue en outre à des effets indésirables tels que les changements d’humeur, un risque accru d’ostéoporose et une diminution de la libido. L’œstrogène systémique est le traitement le plus efficace pour les symptômes vasomoteurs, tandis que les symptômes génito-urinaires associés à la ménopause doivent être traités avec de l’œstrogène topique à faible dose.,1 L’étude observationnelle de la santé des femmes à travers le Pays a révélé que les femmes éprouvent des symptômes vasomoteurs pendant une moyenne de 7,4 ans après la ménopause.2 Cependant, la plupart des cliniciens conseillent que le traitement ne dure pas plus de 5 ans après la ménopause et recommandent fortement d’éviter complètement l’hormonothérapie chez les femmes de plus de 60 ans.1 Le clinicien doit peser soigneusement les risques et les avantages associés aux hormones synthétiques et composées tout en gardant à l’esprit l’objectif principal d’améliorer la qualité de vie du patient.,
Hormones bioidentiques
Les hormones bioidentiques, telles que les œstrogènes, les progestatifs et les androgènes, sont des composés préparés selon le chapitre USP<795> Normes de composition non stériles. Ces hormones peuvent être composées dans une variété de doses et de formes posologiques, créant de nombreuses options pour les femmes intéressées par l’hormonothérapie composée (CHT)., Les formulations composées ne subissent pas les tests stricts de fabrication et de pureté que leurs homologues approuvés par la FDA; cependant, malgré cet environnement non réglementé, le CHT est largement populaire auprès des patients qui recherchent un médicament plus « personnalisé”.
L’Endocrine Society a défini les hormones bioidentiques composées comme des « composés qui ont exactement la même structure chimique et moléculaire que les hormones produites dans le corps humain., »3 La FDA affirme que le terme hormone bioidentique est purement une stratégie de marketing, car il n’y a aucune base scientifique pour une réduction implicite des avantages ou des risques pour le CHT par rapport à l’hormonothérapie synthétique approuvée par la FDA.3
Hormonothérapie synthétique
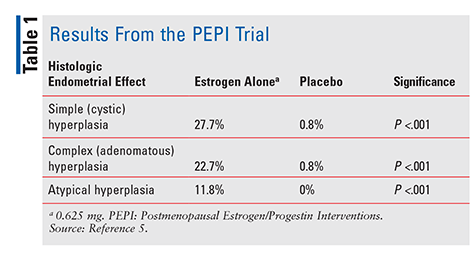
La FDA a approuvé le diéthylstilbestrol en 1941 et les œstrogènes équins conjugués (CEE) en 1942 pour traiter les symptômes de la ménopause.4 À partir des années 1960, les ventes d’œstrogènes ont explosé jusqu’en 1975, lorsque des rapports ont fait surface selon lesquels l’utilisation d’œstrogènes pourrait être associée à un risque accru de cancer de l’endomètre.,4 Cependant, ces rapports ont été largement ignorés, et l’utilisation d’œstrogènes suite. Ce n’est qu’en 1996, lorsque l’essai Postmenopausal Oestrogène/Progestatif Interventions (PEPI) a été publié, que les fournisseurs de soins de santé ont commencé à vraiment comprendre les effets négatifs potentiels associés à la thérapie par les œstrogènes. PEPI était un essai multicentrique randomisé de 3 ans, contrôlé par placebo, en double aveugle, qui a examiné les effets histologiques de l’endomètre du traitement avec des œstrogènes synthétiques sans opposition par rapport à trois schémas différents d’œstrogènes synthétiques plus progestatifs.,5
Dans l’essai PEPI, un nombre significativement plus élevé de sujets ayant reçu de l’œstrogène seul ont développé une hyperplasie de l’endomètre simple, complexe ou atypique par rapport aux sujets ayant reçu un placebo (TABLEAU 1). De plus, bien que les pourcentages exacts n’aient pas été précisés, les taux d’hyperplasie chez les sujets ayant reçu l’un des trois régimes œstrogènes plus progestatifs étaient similaires à ceux des sujets ayant reçu un placebo.5 En résumé, l’administration d’œstrogène seul à une dose de 0.,625 mg par jour ont entraîné une augmentation significative de l’incidence de l’hyperplasie de l’endomètre, tandis que la combinaison de l’CEE et du progestatif protégeait considérablement l’endomètre de la prolifération.5 En raison de ce risque avéré de cancer de l’endomètre, le progestatif est toujours administré en association avec l’œstrogène chez les femmes dont l’utérus est intact. Confirmant encore ce risque, une série de cas de 2007 a décrit trois femmes qui ont utilisé du CHT contenant des doses sous-thérapeutiques de progestatif et qui ont ensuite développé un cancer de l’endomètre.,6
L’essai PEPI, ainsi que les résultats sur 16 068 femmes ménopausées de l’Initiative pour la santé des femmes (WHI) publiés en 2002, ont mis en lumière les graves préoccupations soulevées dans les années 19707.avec le produit combiné, le WHI a constaté une augmentation significative des risques associés à l’utilisation d’hormones synthétiques, tels que les maladies cardiovasculaires, les accidents vasculaires cérébraux, les événements thromboemboliques et le cancer du sein.,7 Il y avait une augmentation de 80% du risque de maladie cardiovasculaire 1 an après l’arrêt du traitement par l’association CEE/acétate de médroxyprogestérone et une augmentation de 37% du risque d’accident vasculaire cérébral ischémique pendant la phase d’intervention avec l’association. En outre, le risque de cancer du sein a été significativement augmenté (24%) pendant l’intervention. L’utilisation d’œstrogènes plus progestatifs a fourni certains avantages, les patients notant une diminution de l’incidence de l’atrophie vaginale, une réduction des symptômes vasomoteurs tels que les bouffées de chaleur et les sueurs nocturnes, et une diminution de 38% du risque de cancer colorectal pendant le traitement par association.,7 Néanmoins, en raison de l’importance du risque accru de cancer du sein et d’événements thromboemboliques, l’essai a été arrêté tôt.
Traitement hormonal composé
Les risques discutés ci-dessus ont ouvert la voie à la défense des intérêts de l’ECCH parce qu’on pensait que l’adaptation ou la personnalisation de l’ECCH au patient individuel maximiserait les avantages et minimiserait le risque. Les allégations selon lesquelles le CHT était plus sûr et biologiquement plus convivial sont devenues plus importantes et son utilisation a augmenté., Pinkerton et Santoro ont utilisé deux enquêtes différentes—Harris et Rose—pour évaluer les connaissances des patients sur le CHT et quantifier l’utilisation du CHT par rapport à l’hormonothérapie approuvée par la FDA, respectivement.8 Les résultats de l’enquête Harris ont indiqué que 86% des femmes âgées de 40 à 65 ans ignoraient que le CHT n’était pas approuvé par la FDA, et les résultats extrapolés de l’enquête Rose ont suggéré que, chaque année, jusqu’à 2,5 millions de femmes de plus de 40 ans peuvent utiliser le CHT.8 Les données des deux enquêtes indiquaient qu’un médecin ou un pharmacien avait recommandé l’ECCH., Ces résultats suggèrent qu’il existe une possibilité pour les fournisseurs de s’assurer que les patients sont informés du produit qu’ils reçoivent, y compris de tous les risques possibles associés à l’hormonothérapie, et pour les pharmaciens en composition de s’assurer qu’ils fournissent un produit thérapeutiquement pur auquel les patients peuvent avoir confiance.
Étant donné que la FDA n’est pas responsable de la normalisation des produits composés, la réglementation incombe souvent aux conseils d’état de la pharmacie., Ces conseils n’ont généralement pas les ressources nécessaires pour effectuer des inspections régulières des pharmacies de préparation, et la FDA n’intervient que lorsqu’une plainte est déposée.9 Bien que les formulations composées ne soient pas légalement tenues de porter des avertissements de risque, théoriquement ces produits peuvent présenter les mêmes risques que ceux mentionnés ci-dessus pour l’hormonothérapie synthétique. À ce jour, cependant, il n’y a pas eu d’essais d’innocuité en tête-à-tête du CHT par rapport aux hormones synthétiques.,10
Il existe trois types d’œstrogènes qu’une femme peut recevoir dans le cadre d’un régime hormonal substitutif composé: estrone (E1), estradiol (E2) et estriol (E3), chacun ayant un degré de puissance variable (E2 >E1 > E3).9 Parce qu’ils rivalisent pour le même récepteur, ces œstrogènes agissent comme des inhibiteurs compétitifs, ce qui entraîne une diminution de l’efficacité s’ils ne sont pas correctement équilibrés.,11 Par conséquent, les partisans du CHT ont mis au point le Biest (E2 + E3 dans une formulation à 20/80) et le Triest (E1 + E2 + E3 dans une formulation à 10/10/80) afin de maximiser la puissance physiologique, mais il n’y a actuellement aucune preuve à l’appui de l’affirmation selon laquelle ces formulations dans ces rapports confèrent11
Bien que dans l’ensemble le CHT ait été insuffisamment étudié et non réglementé, en octobre 2018, sur la base des résultats de l’essai REPLENISH, Bijuva est devenu la première formulation bioidentical de combinaison 17-beta estradiol-progestérone approuvée par la FDA., REPLENISH, une étude multicentrique de phase III, randomisée, en double aveugle, contrôlée par placebo, a étudié l’efficacité, la sécurité endométriale et la sécurité globale de quatre doses différentes d’une seule capsule 17-beta estradiol-progestérone pour les symptômes vasomoteurs modérés à sévères chez les femmes ménopausées.12 Le critère principal de tolérance était l’incidence de l’hyperplasie de l’endomètre à 12 mois. À 12 mois, aucun cas d’hyperplasie de l’endomètre n’a été observé pour aucune des formulations posologiques estradiol-progestérone.,12 À 12 semaines, la formulation estradiol 1 mg–progestérone 100 mg a montré la plus grande réduction statistiquement significative de la fréquence et de la gravité des symptômes vasomoteurs par rapport au placebo, tout en maintenant les normes de sécurité primaires.12 Cependant, comme mentionné précédemment, il n’y a pas eu d’essais comparant l’innocuité des hormones synthétiques aux formulations d’hormones bioidentiques, donc théoriquement les risques demeurent.,
Conclusion
Sur la base de l’essai REPLENISH, les femmes pré, péri et postménopausées ont maintenant un traitement standardisé, réglementé, bioidentique, approuvé par la FDA pour les symptômes vasomoteurs. Des essais futurs sont nécessaires pour définir complètement le profil d’innocuité du 17-bêta-estradiol et du CHT. Les pharmaciens devraient recommander toute formulation hormonale orale pour la durée la plus courte possible., En outre, si le CHT est choisi, les pharmaciens devraient s’assurer que leurs patients savent ce qu’est le CHT et en quoi il diffère des hormones synthétiques tout en ayant une conversation franche sur les avantages et les risques de l’hormonothérapie substitutive.
1. Martin KA, Manson JE. Approche du patient présentant des symptômes ménopausiques. J Clin Endocrinol Metab. 2008;93(12):4567-4575.
2. Avis NE, Crawford SL, Greendale G, et coll. Durée des symptômes vasomoteurs ménopausiques au cours de la transition de la ménopause. JAMA Intern Med. 2015;175(4):531-539.
3. Santoro N, Braunstein GD, Butts CL, et coll., Composé des hormones bio-identiques en endocrinologie de la pratique: un système Endocrinien de la Société de l’énoncé scientifique. J Clin Endocrinol Metab. 2016;101(4):1318-1343.
4. Stefanick ML. Oestrogènes et progestatifs: contexte et historique, tendances d’utilisation, directives et schémas thérapeutiques approuvés par la Food and Drug Administration des États-Unis. Am J Med. 2005; 118 (suppl 12B): 64 à 73.
5. Groupe de rédaction pour le procès PEPI. Effets de la thérapie de remplacement d’hormone sur l’histologie de l’endomètre chez les femmes ménopausées. L’essai Postmenopausal Oestrogène/Progestatif Interventions (PEPI). JAMA. 1996;275(5):370-375.
6., Eden JA, Hacker NF, Fortune M. Trois cas de cancer de l’endomètre associés à un traitement hormonal substitutif « bioidentique”. Med J Aust. 2007;187(4):244-245.
7. Rossouw JE, Anderson GL, Prentice RL, et coll. Risques et avantages de l’œstrogène et du progestatif chez les femmes ménopausées en bonne santé: principaux résultats de l’essai contrôlé randomisé de la Women’s Health Initiative. JAMA. 2002;288(3):321-333.
8. Pinkerton JV, Santoro N. Hormonothérapie bioidentique composée: identifier les tendances d’utilisation et les lacunes dans les connaissances chez les femmes américaines. Ménopause. 2015;22(9):926-936.
9. Bhavnani BR, Stanczyk FZ., Idée fausse et préoccupations concernant les hormones bioidentiques utilisées pour l’hormonothérapie composée sur mesure. J Clin Endocrinol Metab. 2012;97(3):756-759.
10. Bijuva (estradiol et progestérone) notice. Boca Raton, FL: TherapeuticsMD, Inc; novembre 2019.
11. Kuhl H. Pharmacologie des œstrogènes et des progestatifs: influence des différentes voies d’administration. Climatériques. 2005; 8 (suppl 1): 3-63.
12. Lobo RA, Archer DF, Kagan R, et coll. Une capsule orale de 17beta-estradiol-progestérone pour les symptômes vasomoteurs chez les femmes ménopausées: un essai contrôlé randomisé. Obstet Gynecol., 2018;132(1):161-170.
Le contenu de cet article est à titre informatif seulement. Le contenu n’est pas destiné à se substituer à des conseils professionnels. La confiance en toute information fournie dans cet article est uniquement à vos propres risques.