Qu’est-ce que la volatilité?
Une substance est dite volatile si elle bout à basse température, passant de la phase liquide à la phase gazeuse.
Les substances qui sont des gaz à température ambiante sont extrêmement volatiles: elles ont une volatilité élevée. Ils ne peuvent être vus que comme des liquides lorsqu’ils sont exposés à de basses températures ou à des pressions élevées.
Le tableau ci-dessous montre certaines substances classées par ordre de point d’ébullition décroissant et de volatilité croissante., Dans le tableau, le bore est la substance la moins volatile et l’hydrogène la plus volatile.,

Volatility and Vapor Pressure
At the molecular level, particles in liquids have a range of kinetic energies.,Les particules les plus énergétiques ont assez d’énergie pour s’échapper du liquide et entrer dans la phase gazeuse. Nous voyons cela comme de l’évaporation.
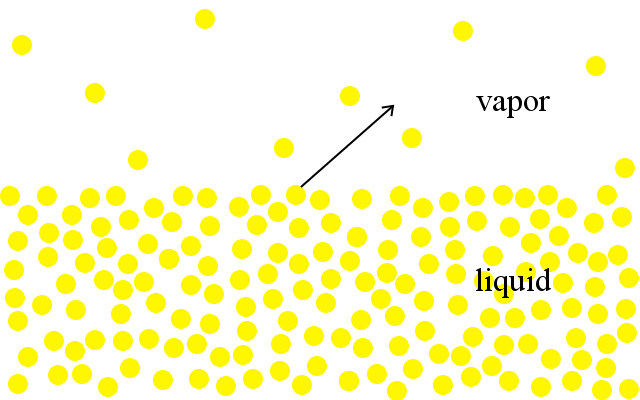
Un liquide bout lorsque la pression de ses particules entrant dans la phase gazeuse augmente pour égaler la pression atmosphérique environnante.
Plus un liquide est proche de son point d’ébullition, plus sa pression de vapeur est élevée.Les liquides à bas point d’ébullition ont des pressions de vapeur plus élevées à n’importe quelle température donnée que les liquides à haut point d’ébullition.
Par conséquent, par exemple, l’acétone avec un point d’ébullition de 56 °C a une pression de vapeur plus élevée que l’eau.,À température ambiante, l’acétone entrera dans la phase vapeur dans une plus grande mesure que l’eau.C’est une caractéristique des liquides volatils.