RÉPONSE LONGUE. Tout d’abord, une distinction doit être faite entre la polarité d’un bond et la polarité d’une molécule (ou composé).
La polarité de liaison fait référence à une séparation de charge électrique qui résulte d’une différence d’électronégativité entre les deux atomes ou groupes qui se lient ensemble.,
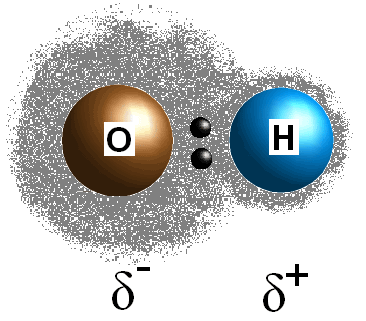
Cette différence de valeurs d’électronégativité entre les deux atomes entraîne un partage inégal des électrons de la liaison, créant ainsi une charge postive (#delta^+#) sur l’atome le moins électronégatif et une charge négative partielle (#delta^(-)#) sur l’atome le plus électronégatif. La polarité d’une liaison peut être déterminée en utilisant uniquement l’électronégativité des valeurs des deux atomes.
Si la liaison entre les deux atomes n’est pas polaire, c’est-à-dire que la différence d’électronégativité entre les deux atomes est inférieure à 0.,5, alors votre molécule sera non polaire. Si la liaison est bien polaire, vous pouvez essayer de déterminer la polarité de la molécule.
La géométrie d’une molécule est un facteur important dans la détermination de la polarité d’une molécule. Ces charges partielles précitées donnent lieu à un moment dipolaire de liaison, #mu#.
Si les orientations de ces moments dipolaires de liaison s’annulent, alors la molécule est dite non polaire. Si toutefois ils ne le font pas, vous avez affaire à une molécule polaire.,
Quelques exemples où les moments dipolaires de liaison s’annulent mutuellement, ce qui donne une molécule non polaire:
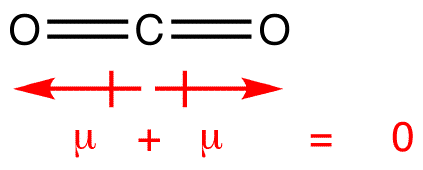
Les moments dipolaires sont dessinés avec la flèche pointant vers l’atome le plus électronégatif et le côté positif sur l’atome le moins électronégatif. Notez que pour #CO_2#, qui a deux liaisons polaires,le moment dipolaire global est nul, puisque ces deux flèches s’annulent mutuellement. Il en résulte une molécule non polaire., La même chose peut être dite pour # BF_3#:
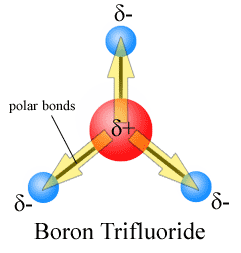
Les trois moments dipolaires s’annulent en raison de la disposition symétrique des liaisons (voir plus sur l’addition de vecteurs).
Un arrangement assymétrique des charges partielles donne une molécule polaire, comme vous pouvez le voir pour l’eau:
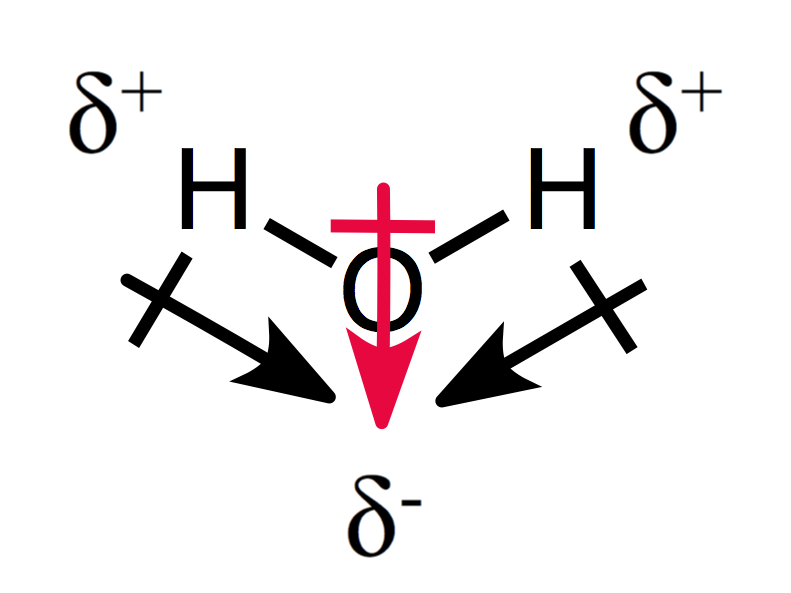
Les deux moments dipolaires s’additionnent créant un moment dipolaire global, et donc une molécule polaire.,
En conclusion, pour prédire la polarité d’une molécule, vous devez connaître les structures de Lewis, l’électronégativité, la théorie VSEPR et la polarité de liaison.