Un titrage est une technique volumétrique dans laquelle une solution d’un réactif (le titrant) est ajoutée à une solution d’un second réactif (l ‘ « analyte ») jusqu’à ce que le point d’équivalence soit atteint. Le point d’équivalence est le point auquel le titrant a été ajouté en quantité exacte pour réagir stoechiométriquement avec l’analyte (lorsque moles de titrant = moles d’analyte). Si le titrant ou l’analyte est coloré, le point d’équivalence est évident à partir de la disparition de la couleur lorsque les réactifs sont consommés., Sinon, un indicateur peut être ajouté qui a un « point final » (change de couleur) au point d’équivalence, ou le point d’équivalence peut être déterminé à partir d’une courbe de titrage. La quantité de titrant ajouté est déterminée à partir de sa concentration et de son volume:
n (mol) = C (mol/L) * V (L)
et la quantité de titrant peut être utilisée dans le calcul stœchiométrique habituel pour déterminer la quantité d’analyte.
Le processus de titrage peut être observé dans la vidéo ci-dessous.,
Un volume mesuré de la solution titrée, dans ce cas, incolore et aqueuse d’acide acétique CH3COOH(aq) est placé dans un bécher. L’hydroxyde de sodium incolore NaOH(aq), qui est le titrant, est ajouté soigneusement au moyen d’une burette. Le volume de titrant ajouté peut alors être déterminé en lisant le niveau de liquide dans la burette avant et après titrage. Cette lecture peut généralement être estimée au centième de millilitre le plus proche, de sorte que des ajouts précis de titrant peuvent être faits rapidement.,
Au fur et à mesure que les premiers millilitres de titrant s’écoulent dans le flacon, certains indicateurs passent brièvement au rose, mais redeviennent rapidement incolores. Cela est dû à un grand excès d’acide acétique. Le réactif limitant NaOH est entièrement consommé.
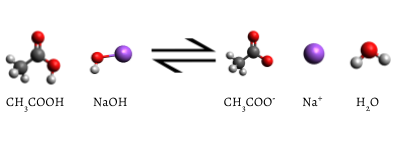
L’indicateur ajouté devient rose lorsque le titrage est terminé, indiquant que tout l’acide acétique aqueux a été consommé par NaOH(aq). La réaction qui se produit est
\
Finalement, tout l’acide acétique est consommé., L’addition même d’une fraction de goutte de titrant produit une couleur rose durable en raison du NaOH qui n’a pas réagi dans le flacon. Le changement de couleur qui se produit à l’extrémité de l’indicateur signale que tous l’acide acétique a été consommé, et nous avons atteint le point d’équivalence du titrage. Si un peu plus de solution de NaOH était ajouté, il y aurait un excès et la couleur de la solution dans le ballon deviendrait beaucoup plus foncée. Le point de terminaison apparaît soudainement et il faut veiller à ne pas dépasser le point de terminaison.
Après que le titrage a atteint le point final, un volume final est lu à partir de la burette., En utilisant la lecture initiale et finale, le volume ajouté peut être déterminé assez précisément:
L’objet d’un titrage est toujours d’ajouter le montant de titrant besoin de consommer exactement la quantité de substance d’être titré. Dans la réaction NaOH—CH3COOH Eq. \(\ref{2}\), le point d’équivalence se produit lorsqu’une quantité molaire égale de NaOH a été ajoutée à partir du cylindre gradué pour chaque mole de CH3COOH initialement dans le ballon de titrage., C’est-à-dire qu’au point d’équivalence, le rapport de la quantité de NaOH ajoutée à la quantité de CH3COOH consommée doit être égal au rapport stœchiométrique
\
Le titrage est souvent utilisé pour déterminer la concentration d’une solution. Dans de nombreux cas, il n’est pas simple d’obtenir une substance pure, de la peser avec précision et de la dissoudre dans une fiole jaugée comme cela a été fait dans l’exemple 1 des concentrations en solution. Le NaOH, par exemple, se combine rapidement avec le H2O et le CO2 de l’air, de sorte que même un échantillon de NaOH solide fraîchement préparé ne sera pas pur., Son poids changerait continuellement à mesure que le CO2(g) et le H2O(g) seraient absorbés. Le chlorure d’hydrogène (HCl) est un gaz à des températures et des pressions ordinaires, ce qui le rend très difficile à manipuler ou à peser. Les solutions aqueuses de ces deux substances doivent être normalisées; c’est, leur concentration doit être déterminée par titrage.
De loin, l’utilisation la plus courante des titrages consiste à déterminer des inconnues, c’est-à-dire à déterminer la concentration ou la quantité de substance dans un échantillon dont nous ne savions rien au départ. L’exemple suivant implique un inconnu que de nombreuses personnes rencontrent chaque jour.,
Les 308,0 mg obtenus dans cet exemple sont raisonnablement en accord avec l’allégation du fabricant de 300 mg. Les comprimés sont estampillés par des machines, pas pesés individuellement, et donc une certaine variation est attendue.