Contexte de la notation D/L
Le système d / l (nommé d’après le latin dexter et laevus, droite et gauche) nomme les molécules en les reliant à la molécule glycéraldéhyde. Le glycéraldéhyde est chiral, et ses deux isomères sont étiquetés d et l (généralement typés en petites capsules dans les travaux publiés)., Certaines manipulations chimiques peuvent être effectuées sur le glycéraldéhyde sans affecter sa configuration, et son utilisation historique à cette fin (éventuellement combinée à sa commodité en tant que l’une des plus petites molécules chirales couramment utilisées) a entraîné son utilisation pour la nomenclature. Dans ce système, les composés sont nommés par analogie avec le glycéraldéhyde, qui, en général, produit des désignations sans ambiguïté, mais est plus facile à voir dans les petites biomolécules similaires au glycéraldéhyde., Un exemple est l’acide aminé chiral alanine, qui a deux isomères optiques, et ils sont marqués en fonction de quel isomère de glycéraldéhyde ils proviennent. D’autre part, la glycine, l’acide aminé dérivé du glycéraldéhyde, n’a pas d’activité optique, car elle n’est pas chirale (achirale).
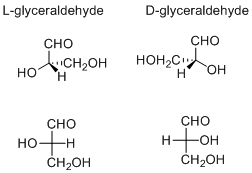
Le d/l étiquetage est pas lié à la (+)/(−); il n’indique pas la énantiomère est dextrogyre et qui est levorotatory., Au contraire, il dit que la stéréochimie du composé est liée à celle de l’énantiomère dextrorotatoire ou lévorotatoire du glycéraldéhyde—l’isomère dextrorotatoire du glycéraldéhyde est, en fait, l’isomère d. Neuf des dix-neuf acides aminés l couramment trouvés dans les protéines sont dextrorotatoires (à une longueur d’onde de 589 nm), et le d-fructose est également appelé lévulose car il est lévorotatoire.