pitkä vastaus. Ensin on tehtävä ero sidoksen polaarisuuden ja molekyylin (tai yhdisteen) polaarisuuden välillä.
Bond napaisuus viittaa erottaminen sähkövaraus, että tulokset elektronegatiivisuus ero välillä kaksi atomit tai ryhmät, joilla bond yhdessä.,
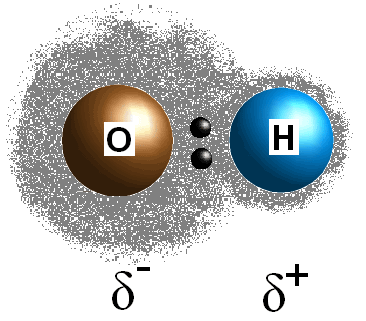
Tämä ero elektronegatiivisuus arvojen välillä kaksi atomien aiheuttaa bondin elektronit jaetaan epätasaisesti, mikä luo postive maksu (#delta^+#) vähemmän electronegative atomin ja osittainen negatiivinen varaus (#delta^(-)#) enemmän electronegative atomin. Sidoksen polaarisuus voidaan määrittää pelkästään kahden aineosatomin elektronegatiivisuusarvojen avulla.
Jos kahden atomin välinen sidos ei ole polaarinen, eli ero elektronegatiivisuudessa kahden atomin välillä on alle 0.,5, sitten molekyyli on ei-polaarinen. Jos sidos on todellakin polaarinen, voit yrittää määrittää molekyylin polaarisuuden.
molekyylin geometria on tärkeä tekijä napaisuus molekyyli. Nämä edellä mainitut osittaiset syytteet synnyttävät bond-dipolihetken, #mu#.
Jos näiden sidosdipolimomenttien orientaatiot kumoavat toisensa, molekyylin sanotaan olevan ei-polaarinen. Jos ne eivät kuitenkaan tee niin, kyseessä on polaarimolekyyli.,
Joitakin esimerkkejä, joissa sidos dipoli hetkiä kumoavat toisensa, jolloin tuloksena on ei-polaarinen molekyyli:
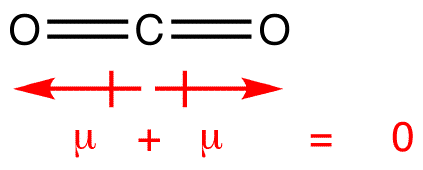
Dipoli hetket ovat piirretty nuoli, joka osoittaa enemmän electronegative atomin ja plus-puolella vähemmän electronegative atomin. Huomaa, että #CO_2#, joka on kaksi polar joukkovelkakirjoja, koko dipoli hetki on nolla, koska nämä kaksi nuolta kumoavat toisensa. Tämä johtaa ei-polaariseen molekyyliin., Samaa voidaan sanoa #BF_3#:
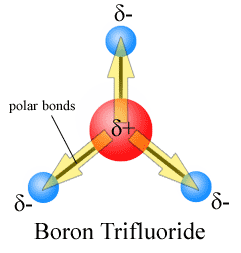
kolme dipoli hetkiä kumoavat toisensa seurauksena symmetrinen järjestely joukkovelkakirjoja (katso lisää vektori lisäksi).
On assymetrical järjestely osittainen maksut tuloksia polaarinen molekyyli, kuten näette vesi:
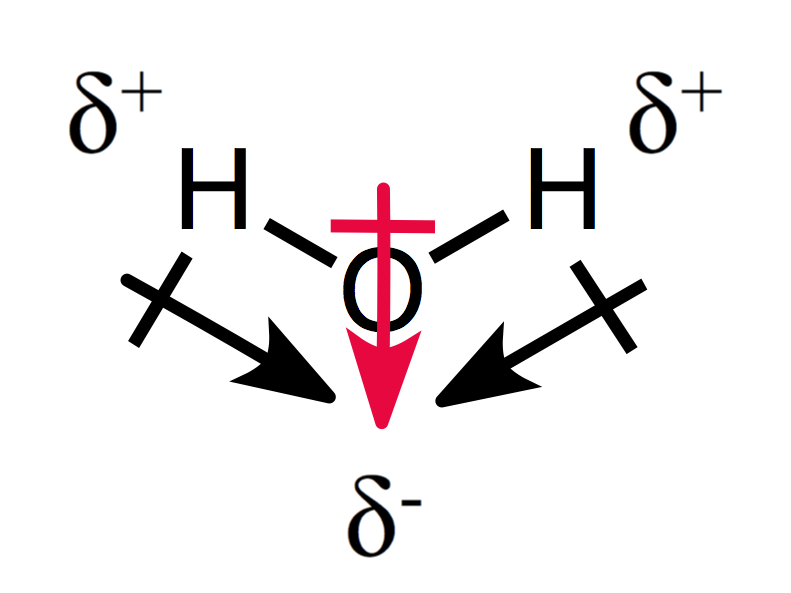
kaksi dipoli hetkiä lisää toisiinsa luoden kokonaisvaltaisen dipoli hetki, jolloin poolinen molekyyli.,
johtopäätöksenä molekyylin polaarisuuden ennustamiseksi on tunnettava Lewis-rakenteet, elektronegatiivisuus, VSEPR-teoria ja bond-polaarisuus.