1Introduction
Krooninen aktiivinen Epstein-Barr virus-infektio (CAEBV) on kliininen termi on alun perin määritelty Straus kuin tauti liittyy krooninen tai pysyviä tartunnan EBV., Ehdotetut kriteerit diagnosoinnissa vakavasta, kroonisesta EBV-infektio sisältää seuraavat: 1) vakava sairaus >6 kuukautta, joka alkoi kuin ensisijainen EBV-infektio ja liittyy selvästi epänormaali EBV vasta-ainetiitterit ; (2) suurempia määriä EBV-DNA: ta tai törkeän epätavallisen korkeat EBV vasta-aineita, esimerkiksi havaitseminen EBV-DNA kudoksissa tai perifeerisen veren Southern blot-hybridisaatiolla; EBV-koodattu pieni RNA-1-positiivisia soluja vaikuttaa kudosten tai perifeerisen veren, >102.,5 kappaletta EBV-DNA: ta/µg DNA perifeerisen veren mononukleaarisissa soluissa, ja törkeästi epätavallisen korkeat EBV vasta-aineita (anti-VCA IgG-tiitterit ≥5120 tai anti-EA IgG-tiitterit ≥640), ja (3) ei ole todisteita edellisen immunologisia poikkeavuuksia tai muut viimeaikaiset infektio, joka saattaa selittää havaitut kunnossa.,4
Perustuu kertyneitä tietoja, CAEBV T-solu-tai NK-solujen tyyppi on hiljattain määritelty systeeminen EBV+ polyklonaalisia, oligoclonal tai usein monoklonaalinen lymfoproliferatiivinen häiriö (LPD) ominaista kuume, pysyviä hepatiitti, hepatosplenomegalia ja lymfadenopatia, joka osoittaa eriasteisia kliinisiä vakavuudesta riippuen immuunivasteen isäntä ja EBV virusmäärä.5,6
CAEBV on usein mukana ihovaurioiden, kuten vakava hyttysen purema allergia-ja hydroa-vacciniforme (HV)-kuten T-solujen lymfoproliferatiivinen sairaus., Hyttysen purema yliherkkyys (tai hyttysen purema allergia, MBH) on ainutlaatuinen ihon ilmentymä CAEBV infektio ominaista poikkeuksellisen voimakas paikallinen reaktio niveljalkaisten purema-alue liittyy systeemisiä oireita ja merkkejä, kuten kuume, lymfadenopatia ja maksan toimintahäiriö. EBV-genomi on pääasiassa MBH – potilaiden perifeerisen veren NK-soluissa, joissa esiintyy usein NK-solujen lymfosytoosia.,7-10
HV-kuten LPD on EBV-liittyvät polyklonaalisia, oligoclonal, tai monoklonaalinen ihon T-solujen lymfoproliferatiivinen sairaus, ominaista toistuvat vesiculopapular tulivuorenpurkaukset, lähinnä kasvot ja kädet. Se osoittaa laajan kirjon kliinistä aggressiivisuutta ja yleensä pitkä kliininen kurssi, jolla on riski kehittää systeeminen lymfooma. Taudin edetessä potilaat kehittää vakavia ja laajoja ihovaurioita liittyy systeemisiä oireita, mukaan lukien kuume, hepatosplenomegalia ja lymfadenopatia., Klassinen HV, vaikea HV ja HV-kuten T-solu lymfooma muodostavat jatkumon kirjo EBV-liittyvät HV-kuten LPD.5,11-14
Äskettäin kolme häiriöt edellä on tunnustettu edustavat kirjo EBV-liittyvät T-solujen ja NK-solujen LPD eri kliiniset esityksiä; yksi systeeminen ja kaksi ihon häiriöt kuten HV-kuten T-solujen LPD ja MBH.14
2Case raportit
potilaat kuvattu seuraavissa kahdessa tapauksessa raportit kuvaavat tyypillisiä kliinisiä oireita CAEBV kanssa MBH lapsilla. Tapauksesta 2 kerrottiin aiemmin.15
2.,1Case 1
15-vuotias korealainen poika oli sairaalaan, joilla on krooninen ajoittainen ihotautien ja eri systeemisiä oireita ja merkkejä, koska hän oli 5-vuotias. Syntymäpaino oli normaali ja riittävä gestaatioikään. Tuoreella lastenosastokäynnillä hän näytti ikäisekseen riittävän korkeutta 163,7 cm, mutta alipainoa 39,6 kg.
5-vuotiaana kuume, yskä ja vatsan turvotus kehittyivät äkillisesti. Valkosolujen määrä oli 12,1 × 103 / µl (lymfosyytit 70%, segmentoituneet neutrofiilit 21%, eosinofiilit 1% ja monosyytit 8%)., Kvalitatiivinen fluoresoiva tumavasta-aine oli negatiivinen. Kliinisen diagnoosin jälkeen suolen perforaatio, hänelle tehtiin subtotaalinen kolektomia ja ileostomia. Yksi kuukausi leikkauksen jälkeen, lymfosyyttien alaryhmä laskee virtaussytometria osoitti alhainen määrä B – ja T-soluja, joilla on selvästi kohonnut NK-solujen (CD16 + CD56+ = 68%, normaalin 5.6-31%); 1,579/µl (normaali vaihteluväli 100-430/µl).,
Hän oli sen jälkeen sairaalahoidossa viisi kertaa 3 vuotta, koska akuutin pharyngotonsillitis, ylempien hengitysteiden infektio, bronkioliitti ja keuhkokuume ja kokenut toistuva kuume kaksi tai kolme kertaa kuukaudessa. 10-vuotiaana hän joutui sairaalaan ylähengitystieinfektion vuoksi. Splenomegalia 10,76 cm löytyi sattumalta työuupumuksen aikana. 10-vuotiaasta alkaen, voimakas ihon vastauksista ilmenee mosquito – tai muita bug-purrut sivustoja, jotka olivat ominaista alkuperäisen rakkulainen vaihtaa seuraa haavaumia, kuori muodostumisen ja arpia, pigmentti (Fig. 1)., Useimmat leesiot olivat läpimitaltaan
cm ja niihin liittyi usein kuumetta. Tällaisia iholeesioita esiintyi yleensä kesällä sekä ylä-ja alaraajoissa. Laboratorio-testien aikaan vakavia hyttysen purema allergia osoitti lievää aspartaattiaminotransferaasi/alaniini transaminaasi – (ASAT/ALAT), joilla on merkittäviä alkalisen fosfataasin (200U/l) ja globin (4.5-4.8 g/dl).
leesiosta saadusta ihobiopsiasta raportoitiin viitteitä Sweetin oireyhtymän mahdollisuudesta. Vatsan sonografia osoitti splenomegaliaa., Perifeerisen veren eritasoiset määrät osoittivat B – ja t-solupopulaatioita sekä NK-solujen lymfosytoosia . Seerumin IgE-taso nostettiin 20 370 U / ml: aan, vaikka spesifistä vastetta erilaisille allergeeniärsykkeille ei havaittu. Huolimatta todistetusta suvusta hyper-IgE-oireyhtymästä tehtiin kliininen vaikutelma ensimmäisenä differentiaalidiagnoosina. Geenitutkimus, johon sisältyi STAT3-sekvensointi, tehtiin, mutta odotettua mutaatiota ei löytynyt., Tarkasteltaessa kliinisen ja NK lymfosytoosi, CAEBV tai EBV: hen liittyvä lymfoproliferatiivinen sairaus, pidettiin muita erotusdiagnooseissa ja asiaankuuluvat testit olivat perustettu.
serologiset testit osoittivat EBV VCA-IgG: n positiivisuutta, EBV-early antigenia ja EBV VCA IgM: n negatiivisuutta. Käyttämällä koko verinäyte, reaaliaikainen kvantitatiivinen PCR EBV-DNA suoritettiin määrittää veren viruspitoisuus (11,450 kopiota/5µl verta). Myöhemmin hän kävi säännöllisesti lääkärintarkastus viruksen genomin kopioiden määrä, jonka todettiin olevan jatkuvasti korkea, vaihdellen 212.,5 kopiota/µl-1 562 kopiota/µl kokoverta. Hänen ihon ongelma liittyy hyttysiä tai vikoja oli esiintynyt ajoittain lähtien, kun taas ajoittainen jaksot kuumeinen sairaus vailla ihon leesio, joka oli myös jatkunut. Epäspesifinen iho-ongelma jatkui 15 kuukautta. Lääkärintarkastuksessa paljastui punoittavia tai ruskehtavia hilseileviä laikkuja, joiden kasvoissa, kaulassa, päänahassa, ylärinnassa ja yläselässä oli kellertäviä sakkaa. Häntä hoidettiin paikallisilla steroideilla ja suun antihistamiineilla seborrooisen dermatiitin vaikutuksesta 11 kuukauden ajan(Kuva. 1)., Kaksi kuukautta ennen tutkimusta hänen oireensa pahenivat ja hän kävi ihotautilääkärillä. Hänen kasvoistaan ja kaulastaan otettiin kaksi ihon koepalaa ja tehtiin EBV in situ hybridization. Myös koepaloja osoitti lisääntynyt lymphoplasma solujen pinnallinen ja syvä dermis, jossa esiintyy satunnaista periadnexal jakelu. Useimmissa imukudossoluissa ei ollut selvää atypiaa. Immunohistokemia osoitti monia CD56 + – imusoluja. Paikalla oli lukuisia lymfosyyttejä, jotka osoittivat ydinpositiivista reaktiota EBERIIN in situ-hybridisaatiossa., Takautuvasti, EBER in situ hybridisaatio oli soveltaa sekä ihon koepala säären otetaan vaikeissa hyttysen purema allergia ja rei ’ itetty suolistossa leikattu 10 vuotta sitten (Kuva. 2). Monet imukudoksen soluja, joilla on positiivinen reaktio todettiin, ei ainoastaan ihoa, mutta myös suolen seinämän ja sinusoids maksan ja imusolmukkeiden, joka vahvisti CAEBV tartunnan hyttysen purema allergia-ja NK-lymfosytoosi. Potilasta hoidettiin konservatiivisesti. Kaksi vuotta myöhemmin hänet otettiin takaisin hemofagosyyttisen lymfohistosytoosin (HLH) vuoksi., Häntä hoidettiin HLH – 2004-hoitosuosituksen mukaisesti16, ja hän reagoi ohimenevästi, mutta sairastui myöhemmin suolen perforaatioon ja kuoli verenmyrkytykseen.
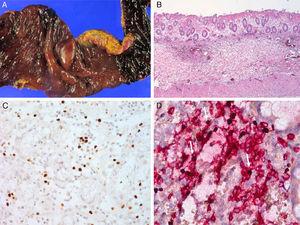
tapaus 1. (A) rei ’ itetty kaksoispiste 5-vuotiaana. (B) mikroskooppiset löydökset osoittavat akuuttia ja kroonista tulehdusta granulaatiokudoksella. (C) EBER in situ hybridisaatio paljastaa EBV-positiivisia lymfosyyttejä. D) EBV-positiiviset lymfosyytit ovat positiivisia CD3: lle.
2.,2Case 2
10-vuotias korealainen poika esitteli Department of Dermatology valittavat voimakas ihon reaktioita hyttysen purema sivustoja. Hänellä oli useita Hajonneita, välimerkkejä alaraajoissa. Merkityn ihoreaktion lisäksi hän kannatti myös systeemisiä oireita, kuten kuumetta hyönteisten puremien jälkeen koko lapsuutensa. Ihon koepala otettiin ja paikallinen hoito vaurion annettiin ilman systeeminen arviointi. 16-vuotiaana potilas myönsi, että hänellä oli 2-3 viikon mittainen käsinkosketeltava massa vasemmassa kaulassa., On lääkärintarkastus, kourallinen suuria imusolmukkeiden oli läsnä vasemmassa kaulan, joista suurin mitattu 7 × 5cm. Koska hänen aiempi ihovaurioita, huolellinen tarkastus hänen jalkansa tehtiin, paljastaen useita matalia haavaumia parantava arvet. Tietokonetomografia ja positroniemissiotomografia tarkistus osoitti useita huonosti tehostaminen ja muuttuvan kokoinen homogeeninen imusolmukkeet, joihin vasen kohdunkaulan alueella ja kahdenvälisten imusolmukkeet alueilla., Lisäksi oli multifokaalinen vaurioita, jotka osoittavat lisääntynyt 2-deoxy-2 – fluoro-D-glukoosi kertymä ihon ja ihonalaisen kerroksen kahdenvälisten posket ja pakarat. On hematologisia tutkimus, verenkuvan ja maitohappo dehydrogenaasi tasolla olivat normaalin rajoissa. Anti-VCA IgG, anti-EA ja anti-EBNA IgG olivat positiivisia ja anti-VCA IgM oli negatiivinen. EBV: n DNA-kopionumero oli 529,8 kopiota/µl kokoverta.,
Imusolmuke biopsia oli tehty paljastaa laajentaminen paracortex kanssa soluttautuminen heterogeeninen tulehdussolujen mukaan lukien pienet lymfosyytit, histiocytes ja monet eosinofiilien. Tulehduksellinen soluttautua oli rytmittävät hajallaan suuri mononukleaaristen tai multinuclear Reed-Sternberg (RS)-kuten epätyypillinen soluja, joka oli suuri eosinofiilinen nucleoli ja paksu ydinvoiman kalvo., Käyttämällä immunohistokemiallinen tutkimus, RS-kuten solujen osoitti vahva kalvo tahra CD30 ja perinuclear värjäystä varten CD15 ja oli positiivinen PAX-5 ja LMP-1, mutta negatiivinen CD20, CD3, ja EBNA-2. Epätyypilliset mononukleaariset ja monikukleaariset RS-tyyppiset solut osoittivat EBER: n myönteisen signaalin situ-hybridisaatiossa. Lisäksi RS-kuin soluja, monet pienet lymfosyytit hajallaan taustalla olivat myös positiivinen EBER in situ hybridisaatio. Luuydinbiopsiassa ei havaittu poikkeavia löydöksiä muutamaa EBV-positiivista pientä lymfosyyttiä lukuun ottamatta., Ihon koepala alueen hyttysen purema allergia vuonna 2002 oli takautuvasti uudelleen, paljastaen vakavia kuolio orvaskeden ja ylempi dermis. Siellä oli soluttautuminen pieniä lymfosyyttejä, histiocytes ja monet eosinofiilien noin verisuonia ja karvatupet ja verisuonen lumenia olivat usein häivytetty punasoluja (Rbc) ja fibriini. Immunohistokemiallinen analyysi osoitti, että tunkeutuu solut olivat heterogeeninen niiden linjaa; jotkut olivat positiivinen CD3 ja CD4-tai CD8 helper tai sytotoksisia T-soluja, kun taas toiset olivat NK-solujen positiivinen CD56., EBER dokumentoi monia EBV-positiivisia soluja situ-hybridisaatiossa. Diagnoosi krooninen aktiivinen EBV tartunnan hyttysen purema yliherkkyys ja monimuotoinen lymphoproliferation simuloimalla Hodgkinin lymfooma oli tehty. Potilas hoidettiin ABVD (Adriamysiini, Bleomysiini, Vinblastin, ja Dakarbatsiinia) kuusi jaksoa, jossa täydellinen remissio. Tällä hetkellä hän pysyy taudista vapaana 7 vuotta hoidon jälkeen.,
3Discussion
kliinisen CAEBV potilaat riippuu tasapainoon EBV liittyviä tekijöitä ja isännän immuunijärjestelmän toimintaa ja voi olla kytee, progressiivinen, tai aggressiivinen. Joillekin potilaille kehittyy EBV + T/NK-solulymfooma / leukemia.4,17 Vuodesta 1998 vuoteen 2014, 13-vuotiaiden potilaiden hoitoon 10-58 vuotta (mediaani-ikä 22 vuotta, yhdeksän urosta ja neljä naarasta) oli diagnosoitu CAEBV sairaus, Samsung Medical Center, Korea (Taulukko 1). Yhteisen kliiniset löydökset mukana kuume (13/13), hepatosplenomegalia (9/12), lymfadenopatia (7/11), NK-lymfosytoosi (3/4), MBH: n (4/13), ja HV-kuten LPD (2/13)., Jotkut potilaat esittivät suolen perforaatiota, Koreaa tai aivoinfarktia. Mediaani seuranta-36 kuukautta, seitsemän potilasta (54%) kuoli tautiin, kaksi potilasta (15%) oli pysyvä sairaus, ja kaksi potilasta (17%) oli vapaa taudista. Kaksi potilasta menehtyi seurantaan. Kuolinsyitä olivat hemofagosyyttinen oireyhtymä ja elinvaurio neljällä potilaalla, EBV-positiivinen T-solulymfooma yhdellä potilaalla ja aggressiivinen NK-soluleukemia yhdellä potilaalla. B-linjan lymfoproliferaatio, joka jäljittelee Hodgkinin lymfoomaa, kuten tapauksessa 2, on harvinainen, mutta sitä on aiemmin raportoitu.,18
CAEBV-infektioon liittyy lähes aina vaihtelevaa lymfoproliferaatiota. EBV-ja EBV – tartunnan saaneiden T-tai NK-solujen klonaalisuus vaihtelee ja voi olla polyklonaalinen, oligoklonaalinen tai monoklonaalinen. Taudin edetessä polyklonaalisesta lymfoproliferaatiosta monoklonaaliseksi taudiksi histologinen atypia lisääntyy. Ohshima ym. ehdotettu luokittelu CAEBV kolmeen ryhmään—polymorfista ja polyklonaalisia, polymorfista ja monoklonaaliset, tai monomorfinen ja monoklonaalisia vasta-perustuu clonality ja histologisia muutoksia.19 sarjassa raportoitu Ohshima et al.,, 8/48 potilaat, joilla on CAEBV infektio oli polyklonaalisia sillä TCR-geenin uudelleenjärjestäytymisen ja soluttautunut soluja näkyviin polymorfinen histomorphology; 15 potilasta osoitti, polymorfinen morfologia ja biclonal tai monoklonaalisia TCR-geenin uudelleenjärjestäytymisen, ja 25 potilasta osoitti, monomorphic histomorphology ja monoklonaalinen TCR-geenin uudelleenjärjestäytymisen. Potilailla, joilla oli monomorfinen ja monoklonaalinen caebv-infektio, oli köyhempiä prognooseja kuin niillä, joilla oli polymorfinen polyklonaalinen tai polymorfinen monoklonaalinen sairaus. Polymorfisten / polyklonaalisten ja polymorfisten/monoklonaalisten ryhmien eloonjäämisessä ei ollut merkittäviä eroja., Monomorfiset / monoklonaaliset caebv-ryhmät Ohshima et al. voi vastata systeemistä T-solujen LPD: tä WHO: n vuoden 2008 luokituksen mukaisesti.20
yhteenvetona, CAEBV on harvinainen EBV: hen liittyvä LPD pääasiassa T-solu-tai NK-solujen lineage laaja kirjo kliinisen esityksen. Taudin tunnistaminen on tärkeää potilaan riittävän hoidon kannalta. EBV-analyysin kautta real-time PCR verinäytteen tai EBV in situ hybridisaatio vaikuttaa kudos on tärkeää välttää näkymät näillä potilailla, ja se olisi sisällytettävä tärkeimmät diagnostiset testit kuumeista lasta.,
eettinen paljastaminen
ihmis-ja eläinaiheiden suojelu. Kirjoittajat toteavat, että ihmisille tai eläimille ei ole tehty kokeita tätä tutkimusta varten.
tietojen luottamuksellisuus. Kirjoittajat kertovat noudattaneensa työkeskuksensa protokollia potilastietojen julkaisemisesta.
oikeus yksityisyyteen ja tietoon perustuva suostumus. Kirjoittajat ilmoittavat, että tässä artikkelissa ei näy potilastietoja.
eturistiriita
kirjoittajat julistaa ei eturistiriidan luonteesta.