Kalvo Proteiineja
Vaikka lipidit ovat olennaisia rakenne-elementtejä kalvoja, proteiinit ovat vastuussa suorittaa erityisiä kalvo toimintoja. Useimmat plasma-kalvot koostuvat noin 50% rasva-ja 50% proteiinia painosta, hiilihydraatti osia glycolipids ja glykoproteiinit muodostavat 5-10% kalvon massa. Koska proteiinit ovat paljon suurempia kuin lipidit, tämä prosenttiosuus vastaa noin yhtä proteiinimolekyyliä jokaista 50-100 lipidimolekyyliä kohti., Vuonna 1972, Jonathan Laulaja ja Garth Nicolson esitti nesteen mosaiikki malli kalvo rakenne, joka on nyt yleisesti hyväksytty perus-paradigma organisaation kaikkien biologisia kalvoja. Tässä mallissa kalvot katsotaan kaksiulotteisiksi nesteiksi, joissa proteiinit työnnetään lipidibileereihin (Kuva 12.3).

Kuva 12.3
Neste mosaiikki malli solukalvon., Kiinteä kalvo proteiineja työnnetään rasva-bilayer, kun taas reuna-proteiinit ovat sidottu kalvo välillisesti proteiini-proteiini-vuorovaikutuksia. Useimmat integraaliset kalvoproteiinit ovat transmembraania (lisää…)
Singer ja Nicolson erottaa kaksi luokkaa kalvo-liittyvät proteiinit, jota he kutsuivat reuna ja kiinteä kalvo proteiineja., Reuna kalvon proteiinit olivat toiminnallisesti määritelty proteiineja, jotka erottaa kalvo seuraavat hoidot polar reagenssit, kuten ratkaisuja äärimmäinen pH tai korkea suolapitoisuus, että ei häiritä fosfolipidin bilayer. Kalvosta dissosioituneena perifeeriset kalvoproteiinit liukenevat vesipuskureihin. Näitä proteiineja ei aseteta lipidikaksikerroksen hydrofobiseen sisätilaan. Sen sijaan ne liittyvät epäsuorasti kalvoihin proteiini-proteiini-interaktioiden kautta., Nämä yhteisvaikutukset liittyy usein ionisidoksia, jotka ovat häirinneet äärimmäinen pH tai korkea suola.
toisin kuin reuna-kalvo proteiineja, kiinteä kalvo proteiineja voidaan vapauttaa vain hoidot, jotka häiritsevät fosfolipidin bilayer. Osia näistä kiinteä kalvo proteiineja työnnetään rasva-bilayer, joten ne voidaan erottaa vain reagenssit, jotka häiritsevät hydrofobinen vuorovaikutus., Yleisimmin käytetyt reagenssit solubilization kiinteä kalvo proteiineja ovat pesuaineet, jotka ovat pieniä amphipathic molekyylejä, jotka sisältävät sekä hydrofobisten ja hydrofiilisten ryhmien (Kuva 12.4). Hydrofobinen osia pesuaineita syrjäyttää kalvolla lipidien ja sitoutuvat hydrofobisia osia kiinteä kalvo proteiineja. Koska pesuainemolekyylin toinen pää on hydrofiilinen, pesuaine-proteiinikompleksit liukenevat vesiliuoksiin.

Kuva 12.4
Solubilization kiinteä kalvo proteiineja, joita pesuaineita., Pesuaineet (esim.oktyyliglukosidi) ovat amfipaattisia molekyylejä, jotka sisältävät hydrofiilisiä pääryhmiä ja hydrofobisia pyrstöjä. Hydrofobiset pyrstöt sitoutuvat integraalikalvon hydrofobisiin alueisiin (more…)
Monet proteiinit ovat olennainen läpäisevä proteiineja, jotka kattavat rasva kaksoiskerroksen kanssa osia alttiina molemmin puolin kalvon. Nämä proteiinit voidaan visualisoida electron micrographs plasman kalvot valmistetaan freeze-fracture tekniikka (ks. Kuva 1.35). Näissä yksilöissä kalvo halkaistaan ja erkanee kahdeksi lehdekseen., Transmembraaniproteiinit näkyvät tällöin partikkeleina kalvon sisäisillä kasvoilla (Kuva 12.5).

Kuva 12.5
Freeze-fracture elektroni micrograph ihmisen punasolujen kalvoja. Kalvon hiukkaset ovat transmembraaniproteiineja. (Harold H. Edwards / Visuals Unlimited.,)
– kalvo-kattavat osia, jotka toimivat proteiinit ovat yleensä α-heliksejä 20 25 hydrofobisia aminohappoja, jotka työnnetään kalvon endoplasmakalvosto aikana synteesi polypeptidiketjun (ks. Luvut 9.11, 9.12, ja 9.13). Nämä proteiinit ovat sitten kuljetetaan kalvo rakkulat päässä endoplasmakalvosto Golgin laitteeseen, ja sieltä plasma-kalvo., Hiilihydraattien ryhmät lisätään polypeptidi ketjut sekä endoplasmakalvoston ja Golgin laitteeseen, joten useimmat toimivat proteiinit solukalvon ovat glykoproteiineja niiden oligosakkarideja altistuvat solun pinnalla.
Tutkimukset punasoluja on saatu hyviä esimerkkejä sekä reuna-ja integraalilaskennan proteiineja liittyy solukalvon. Ihmisen erytrosyyttien kalvoissa on kymmenkunta pääproteiinia, jotka alun perin tunnistettiin kalvovalmisteiden geelielektroforeesilla., Useimmat näistä ovat reuna-kalvo proteiineja, jotka on tunnistettu komponenttien aivokuoren tukiranka, joka perustuu solukalvon ja määrittää solun muodon (ks. Luku 11). Esimerkiksi punasolujen runsain perifeerinen kalvoproteiini on spectrin, joka on erytrosyyttien tärkein sytoskeletaalinen proteiini. Muita punasolujen perifeerisiä kalvoproteiineja ovat aktiini, ankyriini ja kaistale 4.1., Ankyrin toimii rehtori yhteys plasman kalvo ja tukiranka sitoutumalla sekä spectrin ja kiinteä kalvo proteiineja band 3 (ks. Kuva 11.11). Ylimääräinen yhteys kalvo ja tukiranka on esittänyt bändi 4.1, joka sitoutuu liittymissä spectrin ja aktiini, sekä glycophorin (muut suuret kiinteä kalvo proteiini, punasolujen).
kaksi suurta kiinteä kalvo proteiineja veren punasolujen, glycophorin ja bändi 3, tarjota hyvin tutkittu esimerkkejä, jotka toimivat proteiinin rakenne (Kuva 12.6)., Glycophorin on pieni glykoproteiinin 131 aminohappoja, jonka molekyylipaino on noin 30 000, joista puolet on proteiinia ja puolet hiilihydraatteja. Glykoforiini läpäisee kalvon yhdellä 23 aminohapon α helix-kalvolla, jonka glykosyloitu aminohappoterminaaliosa altistuu solun pinnalle. Vaikka glykoforiini oli yksi ensimmäisistä transmembraaniproteiineista, sen tarkkaa toimintaa ei tunneta. Sen sijaan punasolujen toisen tärkeän transmembraaniproteiinin toiminta ymmärretään hyvin., Tämä proteiini, alun perin nimellä band 3, on anion transporter vastuussa kulkua bikarbonaatti (HCO3-) ja kloridi (Cl -) – ioneja koko punasolujen kalvo. Band 3-polypeptidiketju on 929 aminohappoa ja sillä arvellaan olevan 14 kalvopäällysteistä α-kierteistä aluetta. Sisällä kalvo, dimeerit band 3 muodostavat pallomaisia rakenteita, jotka sisältävät sisäisiä kanavia, joiden kautta ionit voivat matkustaa ympäri rasva bilayer.
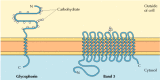
Kuva 12.6
Kiinteä kalvo proteiineja punasoluja., Glykoforiini (131 aminohappoa) sisältää yhden transmembraanin α helixin. Se on voimakkaasti glykosyloitunut, ja oligosakkaridit kiinnittyvät 16 kohtaan polypeptidiketjun solunulkoisessa osassa. (enemmän…)
Koska niiden amphipathic merkki, läpäisevä proteiineja ovat osoittautuneet vaikea kiteyttää, koska tarvitaan kolmiulotteinen rakenne-analyysi X-ray diffraction., Ensimmäinen läpäisevä proteiini analysoidaan X-ray crystallography oli fotosynteesin reaktion keskus bakteeri Rhodopseudomonas viridis, jonka rakenne oli raportoitu vuonna 1985 (Kuva 12.7). Reaktio center sisältää kolme läpäisevä proteiineja, nimetty L, M, ja H (kevyt, medium ja raskas) mukaan niiden näennäinen koot merkitty geeli elektroforeesi. L-ja M-alayksiköissä on kullakin viisi kalvopäällysteistä α-heliittiä. H-alayksikkö on vain yksi läpäisevä α-helix, jossa suurin osa polypeptidi ketju sytosolisen puolella kalvon., Neljäs alayksikköön reaktio center on sytokromi, joka on reuna-kalvo proteiini sidottu monimutkainen proteiini-proteiini-vuorovaikutuksia.

Kuva 12.7
bakteeri fotosynteesin reaktion center. Reaktio keskus koostuu kolmesta läpäisevä proteiineja, nimetty L (punainen), M (keltainen), ja S (vihreä). L-ja M-alayksiköissä on kullakin viisi transmembraani α-heliittiä, kun taas H-alayksikössä on vain (enemmän…)
Vaikka useimmat läpäisevä proteiineja span kalvo, jonka α-kierteisen alueilla, tämä ei aina tapahdu., Hyvin tunnettu poikkeus on esittänyt porins—luokan proteiineja, jotka muodostavat kanavia ulompi limakalvojen jotkut bakteerit. Monet bakteerit, kuten E. coli, on dual-kalvo järjestelmä, jossa solukalvon (tai sisempi kalvo) ympäröi soluseinä ja erillinen ulompi kalvo (Kuva 12.8). Toisin kuin plasmakalvostossa, ulompi kalvo läpäisee hyvin ioneja ja pieniä polaarisia molekyylejä (E. colin tapauksessa molekyylipaino jopa 600). Tämä läpäisevyys johtuu poriineista, jotka muodostavat avoimia vesikanavia lipidikaksikerroksen kautta., Kuten Luvussa 10, proteiineja, jotka liittyvät bakteeri-porins löytyy myös ulommat kalvot mitokondrioita ja kloroplasteissa.
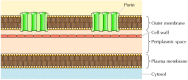
Kuva 12.8
Bakteeri ulommat kalvot. Solukalvon jotkut bakteerit ympäröi soluseinä ja erillinen ulompi kalvo. Ulompi kalvo sisältää poriineja, jotka muodostavat avoimia vesikanavia, jotka mahdollistavat ionien ja pienten molekyylien vapaan kulun.
Rakenteellinen analyysi on osoittanut, että porins eivät sisällä hydrofobisia α-kierteisen alueilla., Sen sijaan, he ylittävät kalvon β tynnyriä, jossa 16 β levyt taittaa osaksi tynnyri-kuten rakenne liittäen vesipitoinen pore (Kuva 12.9). Polaaristen aminohappojen sivuketjut linjaavat huokosia, kun taas hydrofobisten aminohappojen sivuketjut vuorovaikuttavat kalvon sisäosan kanssa. Poriinimonomeerit yhtyvät muodostaen stabiileja trimeerejä, joista jokaisessa on kolme avointa kanavaa, joiden kautta polaarimolekyylit voivat diffundoitua kalvon poikki.

Kuva 12.9
Rakenne porin monomeeri., Jokainen monomeeri on β-tynnyri, joka koostuu 16 antiparallel β-säikeestä (nuolista). Molekyylin yläpää kohtaa ulkoisen väliaineen. (H. Nikaidosta, 1994. J. Biol. Kem. 269: 3905.)
toisin kuin läpäisevä proteiineja, erilaisia proteiineja (joista monet käyttäytyvät kuin kiinteä kalvo proteiineja) ovat ankkuroitu plasma-kalvo, jonka kovalenttisesti kiinnitetty lipidien tai glycolipids (Kuvio 12.10). Glykosyylifosfatidyylinositoli (GPI) ankkuroi yhden proteiiniluokan jäsenet plasmakalvon ulompaan pakkausselosteeseen., GPI-ankkurit lisätään tiettyjä proteiineja, jotka on siirretty endoplasmakalvosto ja ovat ankkuroitu kalvo, jonka C-terminaali läpäisevä alue (ks. Kuva 9.16). Läpäisevä alue on halkaistut kuin GPI-ankkuri on lisätty, joten nämä proteiinit pysyvät kiinnitetty kalvo vain glycolipid. Koska polypeptidi ketjut GPI-ankkuroituja proteiineja siirretään osaksi endoplasmakalvosto, ne ovat glykosyloitu ja altistuvat pinnalla solun seuraavat kuljetus solukalvon.
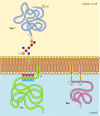
Kuva 12.,10
esimerkkejä plasman kalvoon lipidien ja glykolipidien avulla ankkuroiduista proteiineista. Jotkut proteiinit (esim. lymfosyyttien proteiinia Sinun-1) ovat ankkuroitu ulompi pakkausseloste plasman kalvo GPI-ankkurit lisätään niiden C-terminus vuonna endoplasmakalvosto. (enemmän…)
Muut proteiinit ovat ankkuroitu sisäinen seloste plasman kalvo kovalenttisesti kiinnitetty rasva. Sen sijaan on käsitelty secretory polku, nämä proteiinit ovat syntetisoitu ilmainen sytosolisen ribosomit ja sitten muutettu lisäämällä rasva., Nämä muutokset sisältävät lisäksi myristiinihappo (14-hiili-rasvahappo) ja amino päähän polypeptidi ketju, lisäksi palmitiinihappo (16 hiiliatomia) puolelle ketjut kysteiini jäämiä, ja lisäksi prenyl ryhmät (15 tai 20 hiiliatomia) puolelle ketjut karboksi-terminaalinen kysteiini jäämiä (ks. Luvut 7.29, 7.30 ja 7.31). Joissakin tapauksissa, nämä proteiinit (joista monet käyttäytyvät kuin reuna kalvon proteiinit) ovat suunnattu plasma-kalvo positiivisesti varautuneita alueita polypeptidi ketju sekä liitteenä oleva rasva., Nämä positiivisesti varautuneet proteiini verkkotunnuksia voivat olla vuorovaikutuksessa negatiivisesti varautunut pää ryhmien fosfatidyyliseriinin sytosolisen kasvot plasma-kalvo. On huomionarvoista, että monet proteiinit ankkuroitu sisäinen seloste solukalvon (sisältää Src ja Ras proteiinit Kuvassa 12.10) on tärkeä rooli signaalien solun pinnan reseptoreihin solunsisäisen tavoitteet, joita käsitellään seuraavassa luvussa.