Oppimisen Tavoitteet
tämän jakson lopussa, voit:
- Kuvaile, miten elektronit löydettiin.
- selitä Millikan öljypisarakokeilu.
- kuvaa Rutherfordin kultafoliokoetta.
- kuvaa Rutherfordin atomin planetaarista mallia.
Vain koska atomit ovat autohallin väliä, elektronit ja ytimet ovat päin atomin., Kokeet, joita oli käytetty löytää elektronit ja ytimet paljastavat joitakin perus ominaisuuksia atomia, ja se voidaan helposti ymmärtää käyttää ideoita, kuten sähköstaattinen ja magneettinen voima, jo käsitelty edellisissä luvuissa.
Maksut ja Sähkömagneettisia Voimia
aiemmissa keskusteluissa, meidän on huomattava, että positiivinen varaus on liittynyt ytimet ja negatiivinen varaus, jossa elektroneja. Olemme käsitelleet myös monia sähkö-ja magneettisia voimia, jotka vaikuttavat varauksiin., Meidän tulee nyt tutkia löytö elektronin ja ytimen niin päin atomin ja tutkia heidän panoksestaan ominaisuudet atomien.
Electron

Kuva 1. Kaasupurkausputki hehkuu, kun siihen levitetään korkea jännite. Elektroneja säteilevä katodi kiihdytetään kohti anodi; ne kiihottaa atomien ja molekyylien kaasun, joka hehkuu vastaus., Kerran kutsutaan Geisslerin putket ja myöhemmin Crookes putket, ne ovat nyt tiedossa, kuten katodisädeputket (Crt) ja löytyy vanhemmat Televisiot, tietokoneen näytöt, ja x-ray-koneet. Kun magneettikenttää käytetään, palkki taipuu negatiiviselle varaukselle odotettuun suuntaan. (luotto: Paul Downey, Flickr),
Kaasua vastuuvapauden tubes, kuten Kuvassa 1, koostuvat evakuoitiin lasiputki, jossa on kaksi metalli elektrodit ja esoteerinen kaasu. Kun elektrodeihin levitetään korkea jännite, kaasu hehkuu. Nämä putket olivat nykyisten neonvalojen esiasteita., He olivat ensin tutkittu vakavasti Heinrich Geissler, saksalainen keksijä ja lasinpuhaltaja, alkaen 1860-luvulla. Englanti tiedemies William Crookes, muun muassa, edelleen tutkia, mitä jonkin aikaa oli nimeltään Crookes putket, jossa elektronit vapautuvat atomien ja molekyylien esoteerinen kaasu putken sisällä ja ovat kiihtyi katodi (negatiivinen) ja anodi (positiivinen), jonka korkea potentiaali., Nämä ”katodi säteet” törmäävät kaasun atomien ja molekyylien ja kiihottaa niitä, jolloin päästöt (EM) sähkömagneettinen säteily, joka saa elektronit’ polku näkyvissä kuin ray, joka leviää ja haihtuu, koska se liikkuu poispäin katodi.
Kaasu vastuuvapauden putket ovat nykyään yleisimmin kutsutaan katodisädeputket, koska säteet ovat peräisin katodi. Crookes osoitti, että elektronit kantavat vauhtia (ne voivat saada pienen melan pyörän pyörimään)., Hän myös totesi, että niiden yleensä suora polku on taivutettu magneetti suuntaan odotettavissa negatiivinen varaus siirtymässä pois katodi. Nämä olivat ensimmäiset suorat merkit elektroneista ja niiden varauksesta.

Kuva 2. J. J. Thomson (luotto: www.firstworldwar.com, via Wikimedia Commons)
englantilainen fyysikko J. J. Thomson (1856-1940) paransi ja laajensi kokeiluja kaasua vastuuvapauden tubes. (Ks. Kuva 2 ja Kuva 3.,) Hän todisti katodisäteiden negatiivisen varauksen sekä magneettisilla että sähkökentillä. Lisäksi hän keräsi säteet metallikuppiin ja löysi ylimääräisen negatiivisen varauksen. Thomson oli myös mahdollisuus mitata suhde vastaa elektronin sen massa, \frac{q_e}{m_e}\\—tärkeä askel löytää todelliset arvot sekä qe ja minua. Kuvassa 4 on katodisädeputki, joka tuottaa kapean elektronisäteen, joka kulkee korkeajännitteiseen virtalähteeseen kytkettyjen latauslevyjen läpi., Sähkökenttä E on valmistettu välillä latauksen levyt, ja katodi-ray-putki on sijoitettu välillä napojen magneetti niin, että sähkökenttä E on kohtisuorassa magneettikenttää B magneetti. Nämä kentät, jotka ovat kohtisuorassa toisiaan vastaan, tuottavat vastakkaisia voimia elektroneille. Kuten keskusteltu massaspektrometrit Enemmän Sovelluksia Magnetismi, jos net voima, koska kentät katoaa, sitten nopeus ladattu hiukkanen on v=\frac{E}{B}\\., Tällä tavalla, Thomson määräytyy nopeuden elektronit ja sitten siirtää palkin ylös ja alas säätämällä sähkökentän.

Kuva 3. Kaavio Thomsonin CRT: stä. (luotto: Kurzon, Wikimedia Commons)

Kuva 4. Tämä kaavio osoittaa, electron beam CRT kulkee ristissä sähkö-ja magneettikentät ja aiheuttaa fosforin hehku kun silmiinpistävää putken.
Kokoontuminen ehdot, olemme \frac{q_e}{m_e}=\frac{a}{E}\\.,
Mikä on niin tärkeää, \frac{q_e}{m_e}\\, suhde electron on vastuussa sen massa? Saatu arvo on
\displaystyle\frac{q_e}{m_e}=-1.76\times10^{11}\text{ C/kg (electron)}\\,
Tämä on valtava määrä, kuten Thomson tajusi, ja se tarkoittaa, että elektroni on hyvin pieni massa. Se oli tiedossa, elektrolyyttistä, että noin 108 C/kg tarvitaan levy on materiaali, tekijä, noin 1000 vähemmän kuin maksu per kilo elektroneja., Thomson lähti tekemään sama kokeilu positiivisesti varautuneita vetyioneja (nyt tiedetään paljain protoneja) ja totesi, maksu per kilo noin 1000 kertaa pienempi kuin elektroni, mikä tarkoittaa, että proton on noin 1000 kertaa enemmän massiivinen kuin elektroni. Tänään, emme tiedä tarkemmin, että
\displaystyle\frac{q_p}{m_p}=9.58\times10^{7}\text{ C/kg (protoni)}\\,
missä qp on vastuussa protoni ja mp on sen massa. Tämä suhde (neljään merkitsevään lukuun) on 1836 kertaa pienempi varaus kilogrammaa kohti kuin elektroni., Koska elektronien ja protonien varaukset ovat yhtä suuret, tämä merkitsee mp = 1836me.
Thomson suorittaa erilaisia kokeiluja, käyttäen erilaisia kaasuja vastuuvapauden putket ja työllistää myös muita menetelmiä, kuten valosähköinen ilmiö, vapauttaa elektroneja atomeista. Hän löysi aina samat ominaisuudet elektronille todistaen sen olevan itsenäinen hiukkanen. Hänen työstään, tärkeät palaset, jotka hän alkoi julkaista vuonna 1897, Thomson sai 1906 Nobelin Fysiikan Palkinnon., Jälkikäteen on vaikea ymmärtää, kuinka hämmästyttävää oli huomata, että atomissa on alirakenne. Thomson itse sanoi: ”vasta kun olin vakuuttunut siitä, että koe ei jättänyt pakoa siitä, julkaisin uskoni atomeja pienempien ruumiiden olemassaoloon.”
Thomson yritti mitata vastaa yksittäisiä elektroneja, mutta hänen menetelmä voisi määrittää sen maksutta vain suuruusluokkaa odotettavissa,.
Koska Faradayn kokeet elektrolyyttistä 1830-luvulla, se oli ollut tiedossa, että noin 100 000 C per mooli tarvittiin levy yksittäin ionisoitua ioneja., Jakamalla tämä määrä ioneja per mooli (eli Avogadron numero), joka oli suunnilleen tiedossa, maksu per ion laskettiin olevan noin 1.6 × 10-19 C, lähellä todellista arvoa.

Kuva 5. Robert Millikan (luotto: Tuntematon Kirjailija, via Wikimedia Commons)
Amerikkalainen fyysikko Robert Millikan (1868-1953) (ks. Kuva 5), päätti parannella Thomsonin koe, mittaus-qe ja oli lopulta pakko kokeilla toista lähestymistapaa, joka on nyt klassinen kokeilu suoritetaan opiskelijat., Millikan Oil drop-kokeilu on esitetty kuvassa 6.
Millikan Oil drop-kokeessa suihkutetaan hienopisaroita öljyä sumuttimesta. Osa näistä latautuu prosessissa ja voidaan sitten suspendoida metallilevyjen väliin levyjen välisellä jännitteellä. Tässä tilanteessa, painon pudotus on tasapainoinen, jonka sähköinen voima:
m dropg = qe E

Kuva 6., Että Millikan öljy pudota kokeilu tuotti ensimmäisen tarkka suora mittaus maksu elektroneja, yksi vakiot luonnossa. Hienot öljypisarat latautuvat ruiskutettaessa. Niiden liikettä havaitaan metallilevyjen välillä, joilla on potentiaalia vastustaa painovoimaa. Gravitaatio-ja sähkövoimien tasapaino mahdollistaa latauksen laskemisen pudotuksessa. Maksu on todettu olevan kvantittunut yksiköissä -1.6 × 10-19 C, ja näin ne määräävät suoraan vastuussa ylimääräiset ja puuttuvat elektronit öljyn tippaa.,
sähkökenttä on tuotettu jännite, ja siten E=\frac{V}{d}\\, ja V on säädetty vain tasapainottaa pudottaa painoa. Pisarat voidaan nähdä heijastuneen valon pisteinä mikroskoopilla, mutta ne ovat liian pieniä suoraan mittaamaan kokoaan ja massaansa. Pisaran massa määritetään tarkkailemalla, kuinka nopeasti se putoaa jännitteen sammuessa. Koska ilmanvastus on erittäin merkittävä nämä submicroscopic laskee, enemmän massiivinen tippaa pudota nopeammin kuin vähemmän massiivinen ja hienostunut sedimentaatio laskelmat voivat paljastaa niiden massa., Öljyä käytetään veden sijaan, koska se ei haihdu helposti, joten massa on lähes vakio. Kun massa pudota tiedetään, charge electron on antanut järjestämällä edellinen yhtälö:
\displaystyle{q}=\frac{m_{\text{pudota}}, g}{E}=\frac{m_{\text{pudota}}gd}{V}\\,
missä d on erottaminen levyt ja V on jännite, joka pitää pudota liikkumatta. (Sama pudotus voidaan havaita useita tunteja nähdä, että se todella on liikkumaton.,) Vuoteen 1913 Millikan oli mitattu vastaava elektroni qe tarkkuus 1%, ja hän paransi tämän kertoimella 10 muutaman vuoden sisällä arvo -1.60 × 10-19 C. Hän totesi myös, että kaikki maksut olivat kerrannaisia perus elektronin varaus ja että äkillisiä muutoksia voi esiintyä elektroneja, jotka on lisätty tai poistettu tippaa. Tästä erittäin perustavanlaatuinen suora mittaus qe ja hänen tutkimuksia valosähköinen vaikutus, Millikan sai 1923 Nobelin fysiikanpalkinnon.,
kun elektronin varaus tunnetaan ja varaus-massa-suhde tunnetaan, voidaan laskea elektronin massa. Se on
\displaystyle{m}=\frac{q_e}{\left(\frac{q_e}{m_e}\right)}\\,
Korvaamalla tunnetut arvot saannot
\displaystyle{m}_e=\frac{-1.60\times10^{-19}\text{ C}}{-1.76\times10^{11}\text{ C/kg}}\\,
tai me = 9.11 × tilanne 1031 kg (elektronin massa), jossa pyöristää virheet on korjattu., Elektronin massa on varmistettu monissa myöhemmissä kokeissa, ja sen tarkkuus on nyt parempi kuin yksi osa miljoonassa. Se on uskomattoman pieni massa ja on edelleen pienin tunnettu massa tahansa hiukkanen, joka on massa. (Jotkut hiukkaset, kuten fotonit, ovat massattomia, eikä niitä voida saattaa lepoon, vaan ne kulkevat valon nopeudella.) Vastaava laskelma antaa muiden hiukkasten massat, myös protonin. Kolme numeroa, massa protoni on nyt tiedetään olevan mp = 1.67 × 10-27 kg (protonin massa), joka on lähes identtinen massa vety-atomin., Thomson ja Millikan olivat tehneet todistaakseen atomien, elektronin, yhden alarakenteen olemassaolon ja osoittaakseen edelleen, että sillä oli vain pieni murto-osa atomin massasta. Atomin ydin sisältää suurimman osan sen massasta, ja ytimen luonne oli täysin unanticipated.
myös toinen kvanttimekaniikan tärkeä ominaisuus alkoi syntyä. Kaikki elektronit ovat identtisiä keskenään. Elektronien varaus ja massa eivät ole keskimääräisiä arvoja, vaan ne ovat ainutlaatuisia arvoja, joita kaikilla elektroneilla on., Tämä koskee muita perusyksiköitä submikroskooppisella tasolla. Kaikki protonit ovat identtisiä keskenään ja niin edelleen.
Tuma
tässä tarkastellaan ensimmäistä suoraa näyttöä tuman koosta ja massasta. Myöhemmissä luvuissa, tarkastelemme monia muita näkökohtia ydinfysiikan, mutta perus tietoa ydinvoiman koko ja massa on niin tärkeää ymmärtää atomin, että pidämme sitä täällä.
Ydinjätteen radioaktiivisuus löydettiin vuonna 1896, ja se oli pian kiivasta tutkimuksessa useita parhaita tutkijoita maailmassa., Joukossa oli uusiseelantilainen Herra Ernest Rutherford, joka teki lukuisia perustavanlaatuisia löytöjä, ja ansaitsi otsikko ”isä ydinfysiikan.”Born in Nelson, Rutherford teki jatko-opintoja Cavendishin laboratoriossa Englannissa, ennen kuin ottaa kantaa McGill Yliopistossa Kanadassa, missä hän teki työtä, joka ansaitsi hänelle Nobel-Palkinnon Kemiassa vuonna 1908. Atomifysiikan ja ydinfysiikan alalla kemian ja fysiikan välillä on paljon päällekkäisyyttä, ja fysiikka tarjoaa perustavaa laatua olevat mahdollistavat teoriat., Hän palasi Englantiin myöhempinä vuosina ja sai kuusi tulevaa nobelistia opiskelijoiksi. Rutherford tutki ydinsäteilyn avulla suoraan atomiytimen kokoa ja massaa. Hänen suunnittelemansa kokeilu on esitetty kuvassa 7. Radioaktiivinen lähteen, joka säteilee alfa-säteily oli sijoitettu johtaa astiaan, jossa on reikä toisessa kyljessä tuottaa palkin alfa hiukkasia, jotka ovat ionisoivaa säteilyä ulos ytimet radioaktiivista lähdettä., Ohut kulta folio oli sijoitettu palkki, ja sironta alpha-hiukkasia havaittiin hehku he aiheuttanut, kun ne iski fosfori näyttö.

Kuva 5. Rutherfordin koe antoi suoran todisteen ytimen koosta ja massasta sirottelemalla alfahiukkasia ohuesta kultafoliosta. Alfa-hiukkasia, joiden energiat noin 5MeV pääsee radioaktiivista lähdettä (joka on pieni metallinen säiliö, jossa tietty määrä radioaktiivinen aine on suljettu), on kollimoitua tulee palkki, ja syksyllä, kun folio., Määrä hiukkasia, jotka tunkeutuvat folio tai hajottaa eri näkökulmista osoittaa, että kulta ytimet ovat hyvin pieniä ja ne sisältävät lähes kaikki kulta-atomin massa. Tähän viittaavat erityisesti alfahiukkaset, jotka hajaantuvat hyvin suuriin kulmiin, aivan kuten maalivahdin päästä pomppiva jalkapallopallo.,
Alfa-hiukkaset olivat tiedossa olevan kaksin verroin veloitetaan positiivinen helium ytimet atomien, joka oli liike-energiaa, jotta 5 MeV, kun pääsee ydinvoima rappeutuminen, joka on hajoamisen ydin epävakaa nuklidi, jonka spontaani emissio varautuneita hiukkasia. Nämä hiukkaset vuorovaikuttavat aineen kanssa enimmäkseen kautta Coulombin voima, ja millä tavalla ne hajaantuvat päässä ytimet voi paljastaa ydin-koko ja massa. Tämä vastaa havainnointia siitä, miten keilapallo sirotellaan esineellä, jota ei voi nähdä suoraan., Koska alfa-hiukkasen energia on niin suuri verrattuna tyypillinen energiat liittyvät atomit (MeV vs. eV), voit odottaa alfa-hiukkaset yksinkertaisesti kaatuu läpi ohut folio paljon kuin nopeammat keilapallo olisi kaatua läpi muutamia kymmeniä rivejä keilailu nastat. Thomson oli visioinut atomin olevan pieni pallo, jossa yhtä suuret määrät positiivista ja negatiivista varausta jaettiin tasaisesti. Tapaus massiivinen alfa hiukkasia kärsisi vain pieniä taipumia tällaisessa mallissa., Sen sijaan Rutherford ja hänen työtoverinsa havaitsivat, että alfahiukkaset hajaantuivat silloin tällöin suuriin kulmiin, jotkut jopa takaisin siihen suuntaan, josta ne tulivat! Yksityiskohtainen analyysi käyttäen liikemäärän säilyminen ja energiaa—erityisesti pieni numero, joka tuli suoraan takaisin—ymmärtää, että kulta ytimet ovat hyvin pieniä verrattuna koko kulta-atomi, sisältävät lähes kaikki atomin massa, ja ovat tiukasti sidoksissa. Koska kulta-ydin on useita kertoja massiivisempi kuin alfahiukkanen, nokkakolari hajottaisi alfahiukkasen suoraan takaisin kohti lähdettä., Lisäksi, mitä pienempi ydin, sitä vähemmän alfahiukkasia, jotka osuisivat yhteen päähän.
Vaikka kokeen tulokset julkaistiin hänen kollegansa vuonna 1909, se otti Rutherford kaksi vuotta vakuuttaa itsensä niiden merkitys. Kuten Thomson ennen häntä, Rutherford oli haluton hyväksymään näin radikaaleja tuloksia. Luonto on pienessä mittakaavassa niin erilainen kuin klassinen maailmamme, että jopa löydön eturintamassa olevat ovat joskus yllättyneitä. Rutherford kirjoitti myöhemmin: ”Se oli melkein yhtä uskomatonta, kuin jos sinulla ampui 15-tuuman kuori pala pehmopaperin ja se tuli takaisin ja lyödä sinua., Harkittuani asiaa tajusin, että tämä hajaantuminen väärinpäin . . . . . . suurin osa atomin massasta oli keskittynyt pieneen ytimeen.”
vuonna 1911 Rutherford julkaisi analyysinsä yhdessä ehdotetun atomin mallin kanssa. Ytimen kooksi määritettiin noin 10-15 metriä eli 100 000 kertaa pienempi kuin atomi. Tämä merkitsee valtavaa tiheyttä, luokkaa 1015 g / cm3, huomattavasti toisin kuin mikään makroskooppinen aine. Myös hiljaista on olemassa aiemmin tuntematon ydinaseiden voimat torjumaan valtava vastenmielinen Coulombin voimat myönteisiä maksut ydin., Valtavat voimat olisivat myös yhdenmukaisia ydinsäteilyn suurten energioiden kanssa.

Kuva 8. Laajennettu näkymä Kultafolion atomeista Rutherfordin kokeessa. Ympyrät edustavat atomeja (halkaisijaltaan noin 10-10 m), kun taas pisteet edustavat ytimiä (halkaisijaltaan noin 10-15 m). Jotta pisteet näkyisivät, ne ovat paljon mittakaavaa suurempia. Suurin osa alfahiukkasista syöksyy läpi, mutta ne eivät vaikuta niihin suuren energiansa ja elektronin pienen massan vuoksi., Jotkut kuitenkin suuntaavat suoraan kohti ydintä ja hajaantuvat suoraan takaisin. Yksityiskohtainen analyysi antaa ytimen koon ja massan.
ytimen pieni koko merkitsee myös sitä, että atomi on sisältä enimmäkseen tyhjä. Itse asiassa, Rutherfordin koe, eniten alfoja meni suoraan läpi kulta folio hyvin vähän sironta, koska elektronit ovat niin pieniä massoja ja koska atom oli enimmäkseen tyhjä ei mitään alfa-osuma., Siellä oli jo vihjeitä siitä samalla Rutherford suoritti kokeita, koska energisiä elektroneja oli havaittu tunkeutua ohut kalvot helpommin kuin odotettiin. Kuvassa 8 esitetään ohuen folion atomien kaavamainen kuvio, jossa atomien kokoa edustavat ympyrät (noin 10-10 m) ja ytimiä edustavat pisteet. (Pisteitä ei ole skaalata—jos ne olisivat, tarvitsisit mikroskoopin nähdä ne.) Useimmat alfahiukkaset kaipaavat pieniä ytimiä ja ovat vain hieman hajallaan elektroneilla., Satunnaisesti (noin kerran 8000 kertaa Rutherfordin koe), alfa osuu ydin pää-ja on hajallaan suoraan taaksepäin.

Kuva 9. Rutherfordin atomin planetaarinen malli sisältää ytimen, elektronien ja atomin koon ominaisuudet. Tämä malli oli ensimmäinen, joka tunnustaa, atomien rakenne, jossa low-massa elektronit kiertävät hyvin pieni, massiivinen ydin kiertää paljon suurempi kuin ydin. Atomi on enimmäkseen tyhjä ja vastaa planeettajärjestelmäämme.,
Perustuu koko ja massa ytimen paljasti hänen kokeilu, sekä massa elektronien, Rutherford ehdotti planeetan mallin atomin. Atomin planeettamalli kuvaa pienimassaisia elektroneja, jotka kiertävät suurimassaista ydintä. Elektroniorbitaalien koot ovat suuria verrattuna ytimen kokoon, ja niissä on enimmäkseen tyhjiötä atomin sisällä. Tämä kuva on analoginen sen kanssa, miten aurinkokuntamme pienimassaiset planeetat kiertävät suurimassaista aurinkoa etäisyyksillä, jotka ovat suuria verrattuna auringon kokoon., Atomissa houkutteleva Coulomb-voima on analoginen planeettajärjestelmän gravitaation kanssa. (KS. Kuva 9.) Huomaa, että kokeellisten tulosten selittämiseen tarvitaan malli tai mielikuva, koska atomi on liian pieni havaittavaksi suoraan näkyvällä valolla.
Rutherfordin atomin planetaarinen malli oli ratkaiseva atomien ominaisuuksien ja niiden vuorovaikutusten ja energioiden ymmärtämisessä, kuten tulemme näkemään seuraavissa jaksoissa. Se oli myös osoitus siitä, miten erilainen luonto on tutusta klassisesta maailmasta pienellä kvanttimekaanisella asteikolla., Löytö alusrakenne kaikille väliä muodossa atomien ja molekyylien oli nyt otettu askel pidemmälle paljastaa alusrakenne atomien, joka oli yksinkertaisempi kuin 92 elementtejä sitten tiedossa. Olemme jatkaneet syvempien alirakenteiden etsimistä, esimerkiksi ytimen sisällä, jonkin verran menestyksellisesti. Myöhemmissä luvuissa, me seuraamme tätä quest keskusteluun kvarkit ja muut alkeishiukkaset, ja me tarkastelemme suuntaan haku näyttää nyt olevan menossa.,
PhET Selvittämään: Rutherfordin Sironta
Miten Rutherford selvittää, atomin rakenne ilman, että voimme nähdä sen? Simuloi kuuluisa kokeilu, jota hän vääräksi jouluvanukas malli atomin tarkkailemalla alfa hiukkasia, terhakka pois atomien ja vahvistetaan, että ne on pieni ydin.
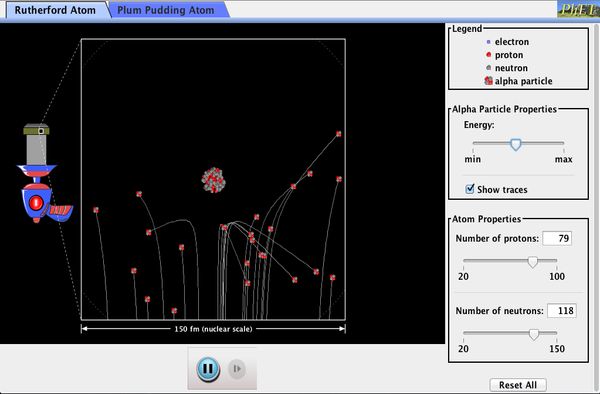
Napsauta ja lataa simulointi. Suorita käyttäen Java.,
– Osion Yhteenveto
Ongelmia & Harjoituksia
- Rutherford löysi koko tuman olla noin 10-15 m. Tämä merkitsi sitä, että suuri tiheys. Mikä tämä tiheys olisi kullalle?
- Millikanin öljypisarakokeessa katsotaan pientä öljypisaraa, joka pidetään liikkumattomana kahden levyn välissä. Ota jännite levyjen välillä on 2033 V ja levyn erottaminen on 2,00 cm. Öljy pudota (tiheys 0.81 g/cm3) halkaisija on 4.0 × 10-6 m. Löytää maksun pudota kannalta electron-yksikköä.,
- (a) pyrkivä fyysikko haluaa rakentaa pienoismalli vetyatomi hänen tieteen reilun projekti. Jos atomi on halkaisijaltaan 1,00 metriä, kuinka suuri hänen pitäisi yrittää tehdä ydin? b) miten helppoa tämä on tehdä?