titraus on tilavuudeltaan tekniikka, jossa ratkaisu yhden lähtöaineen (titrausliuoksen) lisätään liuokseen, jossa on toisen lähtöaineen (the ”analyytin”), kunnes vastaavuus piste on saavutettu. Vastaavuus piste on kohta, jossa titrant on lisätty juuri oikea määrä reagoida stoichiometrically kanssa analyten (kun moolia titrant = moolia analyytin) pitoisuutta. Jos joko titrant tai analyytin on värillinen, vastaavuus vaiheessa on selvää, katoaminen väri reagenssit ovat kulutetaan., Muuten, indikaattori voidaan lisätä, joka on ”päätepiste” (vaihtaa väriä) klo vastaavuus kohta, tai vastaavuus-kohdassa voidaan määrittää titraamalla käyrä. Määrä lisätty titrant määräytyy sen pitoisuus ja tilavuus:
n (mol) = C (mol/L) * V (L)
ja määrä titrant voidaan käyttää tavallista stoikiometrinen laskenta määrittää määrä analyyttiä.
titrausprosessi on nähtävissä alla olevalla videolla.,
mitattu liuoksen tilavuus pienennettävä, tässä tapauksessa, väritön vesiliuos etikkahappo, CH3COOH(aq) sijoitetaan dekantterilasiin. Väritön natriumhydroksidi NaOH(aq), joka on titrausliuoksen, lisätään varovasti avulla buret. Määrä titrant lisätty, voidaan määrittää lukemalla taso neste buret ennen ja jälkeen titraus. Tämä lukema voidaan yleensä arvioida lähimmäksi millilitran sadasosaksi, joten titrantin tarkat lisäykset voidaan tehdä nopeasti.,
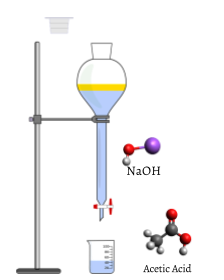
Koska ensimmäinen pari millilitraa titrant virtaa pulloon, jotkut ilmaisin lyhyesti muutoksia vaaleanpunainen, mutta palaa väritön nopeasti. Tämä johtuu suuresta ylimäärästä etikkahappoa. Rajoittava reagenssi NaOH kuluu kokonaan.
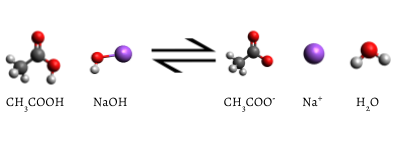
lisätty indikaattori muuttuu vaaleanpunaiseksi, kun titraus on valmis, mikä osoittaa, että kaikki vesi etikkahappo on käytetty NaOH(aq). Reaktio, joka tapahtuu on,
\
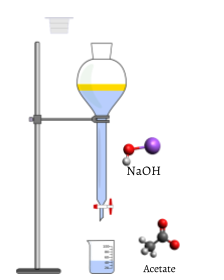
Lopulta, kaikki etikkahappoa kuluu., Lisäksi edes murto-osa tippa titrant tuottaa pysyviä vaaleanpunainen väri johtuu reagoimattoman NaOH: n mittapulloon. Väri muutos, joka tapahtuu päätetapahtuma osoitin signaaleja, että kaikki etikkahappo on kulutettu, joten olemme päässeet vastaavuus pisteen titrauksella. Jos NaOH-liuosta lisättäisiin hieman enemmän, sitä olisi liikaa ja pullossa olevan liuoksen väri muuttuisi paljon tummemmaksi. Päätepiste ilmestyy yhtäkkiä, ja on varottava ylittämästä päätepistettä.
kun titraus on saavuttanut päätepisteen, buretilta luetaan lopullinen tilavuus., Käyttäen alkuperäisen ja lopullisen käsittelyn lisätty tilavuus voidaan määrittää melko tarkasti:
kohde titraus on aina lisätä määrä titrant tarvitsi kuluttaa täsmälleen aineen määrä on titrattu. NaOH-CH3COOH-reaktiossa taajuuskorjain. \(\ref{2}\), vastaavuus kohta tapahtuu, kun yhtä molaarinen määrä NaOH: a on lisätty vuodesta valmistui sylinteri jokaista moolia CH3COOH alun perin titraus pulloon., Että on, on vastaavuus vaiheessa suhde määrä NaOH: a, lisätään määrä CH3COOH kulutetaan on yhtä stoikiometrinen suhde
\
Titraus on usein käytetään määrittämään pitoisuus ratkaisu. Monissa tapauksissa ei ole yksinkertaista saada puhdasta ainetta, punnita se tarkasti ja liuottaa se mittapulloon, kuten esimerkiksi 1 liuoksen pitoisuuksista tehtiin. NaOH, esimerkiksi, yhdistää nopeasti H2O ja CO2 ilmasta, ja niin edes juuri valmistettu näyte kiinteää NaOH: a ei ole puhdas., Sen paino muuttuisi jatkuvasti, kun CO2(g) ja H2O (g) imeytyisivät. Vetykloridi (HCl) on kaasu tavanomaisissa lämpötiloissa ja paineissa, jolloin sen käsittely tai punnitseminen on hyvin vaikeaa. Molempien aineiden vesiliuokset on standardoitava, eli niiden pitoisuudet on määritettävä titraamalla.
ylivoimaisesti yleisin käyttö titrauksia on määritettäessä tuntemattomia, että on, määrittää pitoisuus tai ainemäärä näytteessä, joista emme aluksi tienneet mitään. Seuraava esimerkki liittyy tuntemattomaan, jonka monet ihmiset kohtaavat joka päivä.,
308.0 mg saadaan tässä esimerkissä on kohtuullisen lähellä sopimusta valmistajan väite 300 mg. Tabletit on leimattu koneilla, niitä ei punnita erikseen, ja siksi on odotettavissa jonkin verran vaihtelua.