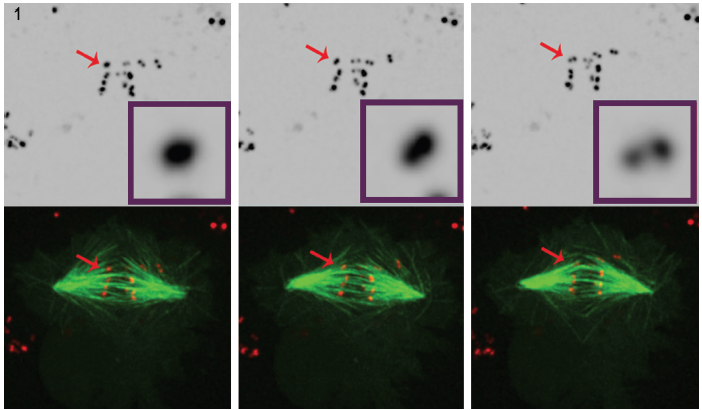
Figura 1. Tres imágenes fijas seleccionadas de una película de células agotadas por POLO muestran claramente que, con el tiempo, la señal intensa de centrómero/cinetocoro (rojo) se resuelve en un par de puntos, lo que demuestra que los cromosomas están sintéticamente Unidos a microtúbulos del huso (Verde). Los conjuntos de datos de microscopía de fluorescencia 4D se recolectaron cada 30 segundos con 0.,Pasos z de 5 mm que cubren todo el volumen celular utilizando un objetivo plan-apocromático de 100 ° y 1.4 NA a 25 ° C con la unidad confocal de disco giratorio Revolution de Andor y la cámara EMCCD de iXon, ambos impulsados por el software de imágenes de células vivas de Andor IQ.
La división celular mitótica se basa en la capacidad de las células para distribuir adecuadamente las cromátidas hermanas en las células formadoras. Para realizar la función de manera confiable, las células utilizan mecanismos de edición internos para corregir los accesorios de fibra cromosómica / husillo incorrectos., Los cinetocoros emparejados generalmente están alineados para unir correctamente las fibras del husillo y segregar la cromatina, sin embargo, los cinetocoros erróneos y desalineados sí resultan. Las células contienen mecanismos de edición especializados para prevenir y corregir estos pares de cinetocoros desalineados, aunque el mecanismo exacto no se conoce bien 1,2 ., Es postulado por Tatiana Moutinho-Santos en la Universidade do Porto, Instituto de Biologia Molecular e Celular de Portugal (IBMC) que la presencia de quinasa POLO es necesaria para promover la bi-orientación cromosómica (denominada disposición anfitélica) y así preservar la alineación cinetocórica adecuada.
para comprender mejor su papel en la regulación del desarrollo del cinetocoro, el Dr. Moutinho dos Santos estudió la Drosophila polo quinasa agotada dentro de las células vivas para corroborar la participación de POLO en las funciones de edición necesarias para mantener la disposición del cinetocoro anfitélico., En este caso, se estudió la disposición sintélica (cinetocoros hermanos unidos a microtúbulos que emanan del mismo huso). El análisis de timelapse de mitosis se realizó en células de Drosophila S2 que expresaban de forma estable CID-mCherry para la visualización de los centrómeros, y GFP-a-tubulina para los microtúbulos. La visualización de los cinetocoros es exigente debido a su pequeño tamaño, baja señal fluorescente y breve apariencia durante la división celular. La microscopía de fluorescencia Confocal se utiliza a menudo para obtener imágenes de cinetocoros, sin embargo, incluso en este entorno, la visualización sigue siendo difícil., Los cinetocoros son muy pequeños (300 nm)3, cercanos a las capacidades de resolución lateral del microscopio de luz, y superan la capacidad de resolución axial del microscopio. Además, la obtención de marcadores fluorescentes en células vivas puede tener efectos fototóxicos y de fotoblanqueo. La iluminación láser intensa puede crear problemas de fototoxicidad, especialmente dañinos para las células vivas que se dividen.
la microscopía confocal de disco giratorio Revolution XD de Andor se emplea para superar el desafío único del Dr. Moutinho dos Santo asociado con la observación de cinetocoros., En este caso, se deben abordar simultáneamente cuatro factores separados para visualizar adecuadamente los procesos celulares dinámicos:
- Velocidad de adquisición
- Capacidad de resolución espacial y temporal
- La capacidad de detectar niveles muy bajos de intensidad de fluorescencia
- Gestión de la señal de fluorescencia disponible
estos temas de resolución espacial, temporal e intensidad se repiten con frecuencia con la microscopía de fluorescencia y a menudo están en desacuerdo con experimentos que involucran la observación de la viabilidad celular., Por ejemplo, las exposiciones prolongadas de la cámara y los períodos prolongados de iluminación de alta intensidad generan los efectos fototóxicos que dañan o destruyen las células vivas. Simultáneamente, las microestructuras ligeramente etiquetadas exigen una exposición más larga para visualizar, pero pueden verse afectadas negativamente por el fotoblanqueo. El problema se complica por la necesidad de combinar los datos tridimensionales tradicionales con los del tiempo. Finalmente, sigue siendo necesario discernir la señal del ruido de fondo y la neblina fuera de foco.
La velocidad de adquisición es de particular importancia para el Dr. Mountinho dos Santos., Las células de Control S2 exhiben un ciclo de división de aproximadamente 30 minutos. Sin embargo, las células S2 agotadas de POLO utilizadas en sus experimentos mostraron un período detenido de más de ocho horas. El registro de la división celular agotada de POLO requiere la recolección de entre 7,200 y 12,000 conjuntos de imágenes (dos fluorocromos fotografiados cada treinta segundos durante una a cinco horas, adquiridos en pasos axiales de 0.5 micras a hasta 20 pasos para la resolución de cinetocoro axial)., La microscopía de fluorescencia convencional y la iluminación láser no permitirán ni los requisitos de iluminación suave necesarios ni la velocidad de adquisición para completar esta tarea sensible al tiempo. Por ejemplo, el rasterizado láser en la microscopía confocal tradicional requiere períodos de tiempo más largos para recoger la señal de la muestra. Los sistemas confocales de disco giratorio se utilizan para superar estas barreras tradicionales y para revelar nuevos conocimientos sobre las técnicas de edición de cinetocoros moleculares.,
en comparación con los sistemas convencionales de fluorescencia de Campo Ancho, la resolución espacial de un disco giratorio confocal es superior tanto en dimensiones laterales (x E y) como axiales (z). A través del escaneo constante de la matriz estenopeica, las muestras se pueden ver en tiempo real con alto contraste, proporcionando imágenes claras en los límites de difracción de la óptica del microscopio. Esto permite la visualización 3D y la comprensión del comportamiento dinámico del cinetocoro en relación con los microtúbulos del husillo., La resolución lateral del cinetocoro y del centrómero de 300 nm y la resolución de la fibra del husillo de 300-500 nm se reportaron y se detallan en la Figura A.
resolución de intensidad
La visualización de los cinetocoros marcados fluorescentemente asociados con cada centrómero impone demandas adicionales al sistema de adquisición. Los centrómeros y cinetocoros en estudio son principalmente visibles solo durante la interfase de división celular. A medida que las células pasan a través de la profase, los centrómeros ya se han resuelto en los Doce Pares cromosómicos típicos de Drosophila., Administrar el presupuesto de luz disponible durante una adquisición prolongada requiere una iluminación suave y una alta resolución capaz de usar técnicas de disco giratorio. Las aberturas dentro de la unidad de disco giratorio proporcionan estos beneficios. Debido a que la luz excita los fluoróforos solo cuando hay una abertura, los efectos fototóxicos se minimizan. Si bien es contrario a la intuición, un presupuesto de luz reducido no indica objetos débiles y difíciles de detectar. La resolución de intensidad se incrementa a través de la exclusión del disco giratorio de la señal fuera de foco y la posterior amplificación de la señal por una arquitectura de cámara EMCCD., Esto crea la nueva posibilidad de generar imágenes de mayor contraste que revelan el desarrollo y la alineación de objetos puntiagudos como los cinetocoros.
conclusiones
el uso de la tecnología de disco giratorio en la aplicación de células vivas del Dr. Mountinho dos Santos llevó a una observación importante. En ausencia de la quinasa POLO, se demostró que las células de Drosophila carecían de los mecanismos correctivos necesarios para mantener la disposición cromosómica anfitélica., Se demostró que la presencia de POLO proporciona el entorno adecuado para una correcta arquitectura de centrómeros, al tiempo que garantiza una adecuada BI-orientación cromosómica. Las células de Drosophila cultivadas sometidas a mitosis en ausencia de cromosomas de cinasa POLO se unen a fibras de huso con orientación sintélica, es decir, con cinetocoros hermanos unidos a microtúbulos que provienen de un solo polo de huso.
esta conclusión se obtuvo mediante un análisis cuidadoso de la microscopía de fluorescencia 4D en células que expresan marcadores de centrómero/ cinetocoro marcados fluorescentemente y microtúbulos. (Figura 1).