objetivos de aprendizaje
al final de esta sección, podrá:
- describir cómo se descubrieron los electrones.
- explica el experimento de gotas de aceite de Millikan.
- Describe el experimento de Rutherford con lámina de oro.
- Describe el modelo planetario del átomo de Rutherford.
así como los átomos son una subestructura de la materia, los electrones y los núcleos son subestructuras del átomo., Los experimentos que se utilizaron para descubrir electrones y núcleos revelan algunas de las propiedades básicas de los átomos y se pueden comprender fácilmente utilizando ideas como la fuerza electrostática y magnética, ya tratadas en capítulos anteriores.
cargas y fuerzas electromagnéticas
en discusiones anteriores, hemos observado que la carga positiva está asociada con los núcleos y la carga negativa con los electrones. También hemos cubierto muchos aspectos de las Fuerzas Eléctricas y magnéticas que afectan las cargas., Ahora exploraremos el descubrimiento del electrón y el núcleo como subestructuras del átomo y examinaremos sus contribuciones a las propiedades de los átomos.
El Electrón

la Figura 1. Un tubo de descarga de gas brilla cuando se le aplica un alto voltaje. Los electrones emitidos desde el cátodo se aceleran hacia el ánodo; excitan átomos y moléculas en el gas, que brillan en respuesta., Una vez llamados tubos Geissler y más tarde tubos Crookes, ahora se conocen como tubos de rayos catódicos (CRT) y se encuentran en televisores más antiguos, pantallas de computadora y máquinas de rayos X. Cuando se aplica un campo magnético, el haz se dobla en la dirección esperada para la carga negativa. (crédito: Paul Downey, Flickr)
Los tubos de descarga de Gas, como los que se muestran en la Figura 1, consisten en un tubo de vidrio evacuado que contiene dos electrodos de metal y un gas enrarecido. Cuando se aplica un alto voltaje a los electrodos, el gas brilla. Estos tubos fueron los precursores de las luces de neón de hoy., Primero fueron estudiados seriamente por Heinrich Geissler, un inventor alemán y soplador de vidrio, a partir de la década de 1860. el científico Inglés William Crookes, entre otros, continuó estudiando lo que durante algún tiempo se denominaron tubos de Crookes, en los que los electrones se liberan de átomos y moléculas en el gas enrarecido dentro del tubo y se aceleran desde el cátodo (negativo) al ánodo (positivo) por el alto potencial., Estos «rayos catódicos» chocan con los átomos y moléculas de gas y los excitan, lo que resulta en la emisión de radiación electromagnética (EM) que hace que la trayectoria de los electrones sea visible como un rayo que se propaga y se desvanece a medida que se aleja del cátodo.
Los tubos de descarga de Gas hoy en día son comúnmente llamados tubos de rayos catódicos, porque los rayos se originan en el cátodo. Crookes mostró que los electrones llevan momento (pueden hacer girar una pequeña rueda de paletas)., También descubrió que su trayectoria normalmente recta está doblada por un imán en la dirección esperada para una carga negativa que se aleja del cátodo. Estas fueron las primeras indicaciones directas de los electrones y su carga.

la Figura 2. J. J. Thomson (crédito: www.firstworldwar.com, vía Wikimedia Commons)
El físico Inglés J. J. Thomson (1856-1940) mejoró y amplió el alcance de los experimentos con tubos de descarga de gas. (Véanse las figuras 2 y 3.,) Verificó la carga negativa de los rayos catódicos con campos magnéticos y eléctricos. Además, recogió los rayos en una taza de metal y encontró un exceso de carga negativa. Thomson también fue capaz de medir la relación de la carga del electrón a su masa, \frac{q_e}{m_e}\\—un paso importante para encontrar los valores reales de qe y me. La figura 4 muestra un tubo de rayos catódicos, que produce un haz estrecho de electrones que pasa a través de placas de carga conectadas a una fuente de alimentación de alto voltaje., Un campo eléctrico E se produce entre las placas de carga, y el tubo de rayos catódicos se coloca entre los polos de un imán de modo que el campo eléctrico E es perpendicular al campo magnético B del imán. Estos campos, siendo perpendiculares entre sí, producen fuerzas opuestas sobre los electrones. Como se discutió para los espectrómetros de masas en más aplicaciones del magnetismo, si la fuerza neta debida a los campos desaparece, entonces la velocidad de la partícula cargada es v=\frac{E}{B}\\., De esta manera, Thomson determinó la velocidad de los electrones y luego movió el haz hacia arriba y hacia abajo ajustando el campo eléctrico.

la Figura 3. Diagram of Thomson’s CRT. (crédito: Kurzon, Wikimedia Commons)

la Figura 4. Este esquema muestra el haz de electrones en un CRT que pasa a través de campos eléctricos y magnéticos cruzados y hace que el fósforo brille al golpear el extremo del tubo.
reuniendo términos, tenemos \frac{q_e}{m_e}=\frac{a}{E}\\.,
¿Qué es tan importante acerca de \frac{q_e} {m_e}\\, la relación entre la carga del electrón y su masa? El valor obtenido es
\displaystyle\frac{q_e}{m_e}=-1.76\times10^{11}\text{ C/kg (electron)}\\
Este es un número enorme, como se dio cuenta Thomson, e implica que el electrón tiene una masa muy pequeña. Se sabía por galvanoplastia que se necesitan aproximadamente 108 C / kg para platear un material, un factor de aproximadamente 1000 menos que la carga por kilogramo de electrones., Thomson pasó a hacer el mismo experimento para iones de hidrógeno cargados positivamente (ahora se sabe que son protones desnudos) y encontró una carga por kilogramo aproximadamente 1000 veces más pequeña que la del electrón, lo que implica que el protón es aproximadamente 1000 veces más masivo que el electrón. Hoy en día, sabemos más precisamente que
\displaystyle\frac{q_p}{m_p}=9.58\times10^{7}\text{ C/kg (protón)}\\,
donde qp es la carga del protón y mp es su masa. Esta relación (a cuatro cifras significativas) es 1836 veces menos carga por kilogramo que para el electrón., Dado que las cargas de electrones y protones son iguales en magnitud, esto implica mp = 1836me.
Thomson realizó una variedad de experimentos utilizando diferentes gases en tubos de descarga y empleando otros métodos, como el efecto fotoeléctrico, para liberar electrones de los átomos. Siempre encontró las mismas propiedades para el electrón, demostrando que es una partícula independiente. Por su trabajo, cuyas importantes piezas comenzó a publicar en 1897, Thomson fue galardonado con el Premio Nobel de Física en 1906., En retrospectiva, es difícil apreciar lo asombroso que fue encontrar que el átomo tiene una subestructura. El propio Thomson dijo: «Fue solo cuando me convencí de que el experimento no dejaba escapar de él que publiqué mi creencia en la existencia de cuerpos más pequeños que átomos.»
Thomson intentó medir la carga de electrones individuales, pero su método podía determinar su carga solo en el orden de magnitud esperado.
desde los experimentos de Faraday con la galvanoplastia en la década de 1830, se sabía que se necesitaban aproximadamente 100,000 C Por mol para platear iones ionizados individualmente., Dividiendo esto por el número de iones por MOL (es decir, por el número de Avogadro), que era aproximadamente conocido, la carga por ion se calculó para ser de aproximadamente 1.6 × 10-19 C, cerca del valor real.

la Figura 5. Robert Millikan (crédito: autor desconocido, vía Wikimedia Commons)
un físico estadounidense, Robert Millikan (1868-1953) (ver Figura 5), decidió mejorar el experimento de Thomson para medir la qe y finalmente se vio obligado a probar otro enfoque, que ahora es un experimento clásico realizado por estudiantes., El experimento de la gota de aceite de Millikan se muestra en la Figura 6.
en el experimento Millikan oil drop, se rocían finas gotas de aceite desde un atomizador. Algunos de estos se cargan por el proceso y luego se pueden suspender entre placas de metal por un voltaje entre las placas. En esta situación, el peso de la gota es equilibrada por la fuerza eléctrica:
m dropg = qe E

la Figura 6., El experimento de Millikan oil drop produjo la primera medición directa precisa de la carga de electrones, una de las constantes más fundamentales de la naturaleza. Las gotas finas de aceite se cargan cuando se rocían. Su movimiento se observa entre placas de metal con un potencial aplicado para oponerse a la fuerza gravitacional. El equilibrio de las fuerzas gravitacionales y eléctricas permite el cálculo de la carga en una caída. La carga se encuentra cuantizada en unidades de -1.6 × 10-19 C, determinando así directamente la carga de los electrones sobrantes y faltantes en las gotas de aceite.,
el campo eléctrico es producido por el voltaje aplicado, por lo tanto, E=\frac{V}{d}\\, y V se ajusta para equilibrar el peso de la gota. Las gotas se pueden ver como puntos de luz reflejada usando un microscopio, pero son demasiado pequeñas para medir directamente su tamaño y masa. La masa de la caída se determina observando qué tan rápido cae cuando se apaga el voltaje. Dado que la resistencia del aire es muy significativa para estas gotas submicroscópicas, las gotas más masivas caen más rápido que las menos masivas, y los cálculos de sedimentación sofisticados pueden revelar su masa., Se usa aceite en lugar de agua, porque no se evapora fácilmente, por lo que la masa es casi constante. Una vez que se conoce la masa de la caída, la carga del electrón se da reordenando la ecuación anterior:
\displaystyle{q}=\frac{m_{\text{drop}}g}{E}=\frac{m_{\text{drop}}gd}{V}\\,
donde d es la separación de las placas y V es el voltaje que mantiene la caída inmóvil. (La misma gota se puede observar durante varias horas para ver que realmente está inmóvil., En 1913 Millikan había medido la carga del electrón qe con una precisión del 1%, y mejoró esto por un factor de 10 en pocos años a un valor de -1.60 × 10-19 C. también observó que todas las cargas eran múltiplos de la carga básica del electrón y que podían ocurrir cambios repentinos en los que se agregaban electrones o se eliminaban de las gotas. Por esta medida directa muy fundamental de la qe y por sus estudios del efecto fotoeléctrico, Millikan fue galardonado con el Premio Nobel de Física en 1923.,
con la carga del electrón conocida y la relación carga-masa conocida, la masa del electrón puede ser calculada. Es
\displaystyle{m}=\frac{q_e}{\left(\frac{q_e}{m_e}\right)}\\
sustituir valores conocidos produce
\displaystyle{M}_e=\frac{-1.60\times10^{-19}\text{ C}}{-1.76\times10^{11}\text{ C/KG}}\\
or me = 9.11 × 10-31 kg (masa de electrones), donde se han corregido los errores de redondeo., La masa del electrón ha sido verificada en muchos experimentos posteriores y ahora se conoce con una precisión de mejor que una parte en un millón. Es una masa increíblemente pequeña y sigue siendo la masa más pequeña conocida de cualquier partícula que tenga masa. (Algunas partículas, como los fotones, no tienen masa y no pueden ser llevadas a reposo, sino que viajan a la velocidad de la luz.) Un cálculo similar da las masas de otras partículas, incluyendo el protón. A tres dígitos, la masa del protón ahora se sabe que es mp = 1.67 × 10-27 kg (masa del protón), que es casi idéntica a la masa de un átomo de hidrógeno., Lo que Thomson y Millikan habían hecho era probar la existencia de una subestructura de átomos, el electrón, y además demostrar que tenía solo una pequeña fracción de la masa de un átomo. El núcleo de un átomo contiene la mayor parte de su masa, y la naturaleza del núcleo fue completamente imprevista.
otra característica importante de la mecánica cuántica también estaba empezando a surgir. Todos los electrones son idénticos entre sí. La carga y la masa de los electrones no son valores promedio; más bien, son valores únicos que tienen todos los electrones., Esto es cierto para otras entidades fundamentales a nivel submicroscópico. Todos los protones son idénticos entre sí, y así sucesivamente.
El Núcleo
Aquí, examinamos la primera evidencia directa de que el tamaño y la masa del núcleo. En capítulos posteriores, examinaremos muchos otros aspectos de la física nuclear, pero la información básica sobre el tamaño y la masa nuclear es tan importante para comprender el átomo que la consideramos aquí.
la radiactividad Nuclear fue descubierta en 1896, y pronto fue objeto de un intenso estudio por parte de varios de los mejores científicos del mundo., Entre ellos estaba el Neozelandés Lord Ernest Rutherford, quien hizo numerosos descubrimientos fundamentales y se ganó el título de «padre de la física nuclear». Nacido en Nelson, Rutherford hizo sus estudios de postgrado en los Laboratorios Cavendish en Inglaterra antes de tomar un puesto en la Universidad McGill en Canadá, donde hizo el trabajo que le valió un Premio Nobel de Química en 1908. En el área de la física atómica y nuclear, hay mucha superposición entre la química y la física, y la física proporciona las teorías fundamentales que permiten., Regresó a Inglaterra en años posteriores y tuvo seis futuros ganadores del Premio Nobel como estudiantes. Rutherford usó radiación nuclear para examinar directamente el tamaño y la masa del núcleo atómico. El experimento que ideó se muestra en la Figura 7. Una fuente radiactiva que emite radiación alfa se colocó en un contenedor de plomo con un agujero en un lado para producir un haz de partículas alfa, que son un tipo de radiación ionizante expulsada por los núcleos de una fuente radiactiva., Se colocó una delgada lámina de oro en el haz, y la dispersión de las partículas alfa se observó por el brillo que causaron cuando golpearon una pantalla de fósforo.

la Figura 5. El experimento de Rutherford dio evidencia directa del tamaño y la masa del núcleo al dispersar partículas alfa de una delgada lámina de oro. Las partículas alfa con energías de aproximadamente 5MeV se emiten desde una fuente radiactiva (que es un pequeño contenedor de metal en el que se sella una cantidad específica de material radiactivo), se Coliman en un haz y caen sobre la lámina., El número de partículas que penetran en la lámina o se dispersan a varios ángulos indica que los núcleos de oro son muy pequeños y contienen casi toda la masa del átomo de oro. Esto es particularmente indicado por las partículas alfa que se dispersan a ángulos muy grandes, al igual que una pelota de fútbol rebotando en la cabeza de un portero.,
se sabía que las partículas alfa eran los núcleos positivos doblemente cargados de átomos de helio que tenían energías cinéticas del orden de 5 MeV cuando se emitían en desintegración nuclear, que es la desintegración del núcleo de un nucleido inestable por la emisión espontánea de partículas cargadas. Estas partículas interactúan con la materia principalmente a través de la fuerza de Coulomb, y la forma en que se dispersan desde los núcleos puede revelar el tamaño y la masa nuclear. Esto es análogo a observar cómo una bola de boliche es dispersada por un objeto que usted no puede ver directamente., Debido a que la energía de la partícula alfa es tan grande en comparación con las energías típicas asociadas con los átomos (MeV versus eV), se esperaría que las partículas alfa simplemente se estrellaran a través de una lámina delgada, al igual que una bola de boliche supersónica se estrellaría a través de unas pocas docenas de filas de bolos. Thomson había imaginado que el átomo sería una pequeña esfera en la que cantidades iguales de carga positiva y negativa se distribuirían uniformemente. Las partículas alfa masivas del incidente solo sufrirían pequeñas desviaciones en un modelo de este tipo., En su lugar, Rutherford y sus colaboradores encontraron que las partículas alfa ocasionalmente se dispersaban a grandes ángulos, ¡algunas incluso de regreso en la dirección de donde venían! El análisis detallado usando la conservación del momento y la energía—particularmente del pequeño número que vino directamente—implicó que los núcleos de oro son muy pequeños en comparación con el tamaño de un átomo de oro, contienen casi toda la masa del átomo y están estrechamente unidos. Dado que el núcleo de oro es varias veces más masivo que la partícula alfa, una colisión frontal dispersaría la partícula alfa directamente hacia la fuente., Además, cuanto más pequeño es el núcleo, menos partículas alfa golpearían una cabeza.
aunque los resultados del experimento fueron publicados por sus colegas en 1909, Rutherford tardó dos años en convencerse de su significado. Como Thomson antes que él, Rutherford era reacio a aceptar resultados tan radicales. La naturaleza a pequeña escala es tan diferente de nuestro mundo clásico que incluso aquellos a la vanguardia del descubrimiento a veces se sorprenden. Rutherford escribió más tarde: «era casi tan increíble como si te despidieran de 15 pulgadas shell en un pedazo de papel de seda y se volvió y golpeó., En consideración, me di cuenta de que esta dispersión hacia atrás . . . . . . la mayor parte de la masa del átomo estaba concentrada en un pequeño núcleo.»
en 1911, Rutherford publicó su análisis junto con un modelo propuesto del átomo. Se determinó que el tamaño del núcleo era de unos 10-15 m, o 100.000 veces más pequeño que el átomo. Esto implica una enorme densidad, del orden de 1015 g/cm3, muy diferente a cualquier materia macroscópica. También está implícita la existencia de fuerzas nucleares previamente desconocidas para contrarrestar las enormes fuerzas repulsivas de Coulomb entre las cargas positivas en el núcleo., Las fuerzas enormes también serían consistentes con las grandes energías emitidas en la radiación nuclear.

la Figura 8. Una vista ampliada de los átomos en la lámina de oro en el experimento de Rutherford. Los círculos representan los átomos (unos 10-10 m de diámetro), mientras que los puntos representan los núcleos (unos 10-15 m de diámetro). Para ser visibles, los puntos son mucho más grandes que la escala. La mayoría de las partículas alfa se estrellan, pero son relativamente inafectadas debido a su alta energía y la pequeña masa del electrón., Algunos, sin embargo, se dirigen directamente hacia un núcleo y se dispersan hacia atrás. Un análisis detallado da el tamaño y la masa del núcleo.
el pequeño tamaño del núcleo también implica que el átomo está mayormente vacío dentro. De hecho, en el experimento de Rutherford, la mayoría de los alfas pasaron directamente a través de la lámina de oro con muy poca dispersión, ya que los electrones tienen masas tan pequeñas y ya que el átomo estaba mayormente vacío sin nada para que el Alfa golpeara., Ya había indicios de esto en el momento en que Rutherford realizó sus experimentos, ya que se había observado que los electrones energéticos penetraban láminas delgadas más fácilmente de lo esperado. La figura 8 muestra un esquema de los átomos en una lámina delgada con círculos que representan el tamaño de los átomos (aproximadamente 10-10 m) y puntos que representan los núcleos. (Los puntos no son para escalar; si lo fueran, necesitarías un microscopio para verlos.) La mayoría de las partículas alfa pierden los pequeños núcleos y solo están ligeramente dispersas por los electrones., Ocasionalmente, (aproximadamente una vez en 8000 veces en el experimento de Rutherford), un alfa golpea un núcleo de frente y se dispersa directamente hacia atrás.

la Figura 9. El modelo planetario del átomo de Rutherford incorpora las características del núcleo, los electrones y el tamaño del átomo. Este modelo fue el PRIMERO en reconocer la estructura de los átomos, en la que electrones de baja masa orbitan un núcleo muy pequeño y masivo en órbitas mucho más grandes que el núcleo. El átomo está mayormente vacío y es análogo a nuestro sistema planetario.,
basado en el tamaño y la masa del núcleo revelada por su experimento, así como la masa de electrones, Rutherford propuso el modelo planetario del átomo. El modelo planetario del átomo muestra electrones de baja masa orbitando un núcleo de gran masa. Los tamaños de las órbitas de los electrones son grandes en comparación con el tamaño del núcleo, con la mayoría de vacío dentro del átomo. Esta imagen es análoga a cómo los planetas de baja masa en nuestro sistema solar orbitan el sol de gran masa a distancias grandes en comparación con el tamaño del sol., En el átomo, la fuerza atractiva de Coulomb es análoga a la gravitación en el sistema planetario. (Véase La Figura 9.) Tenga en cuenta que se necesita un modelo o imagen mental para explicar los resultados experimentales, ya que el átomo es demasiado pequeño para ser observado directamente con luz visible.
El modelo planetario del átomo de Rutherford fue crucial para comprender las características de los átomos, y sus interacciones y energías, como veremos en las siguientes secciones. Además, fue una indicación de cuán diferente es la naturaleza del familiar mundo clásico en la pequeña escala de la mecánica cuántica., El descubrimiento de una subestructura a toda la materia en forma de átomos y moléculas se estaba dando ahora un paso más allá para revelar una subestructura de átomos que era más simple que los 92 elementos entonces conocidos. Hemos seguido buscando subestructuras más profundas, como las que están dentro del núcleo, con cierto éxito. En capítulos posteriores, seguiremos esta búsqueda en la discusión de los quarks y otras partículas elementales, y veremos la dirección en la que parece dirigirse la búsqueda ahora.,
Phet Explorations: Rutherford Scattering
¿Cómo descubrió Rutherford la estructura del átomo sin poder verla? Simula el famoso experimento en el que refutó el modelo de pudín de ciruela del átomo observando partículas alfa rebotando en los átomos y determinando que deben tener un pequeño núcleo.
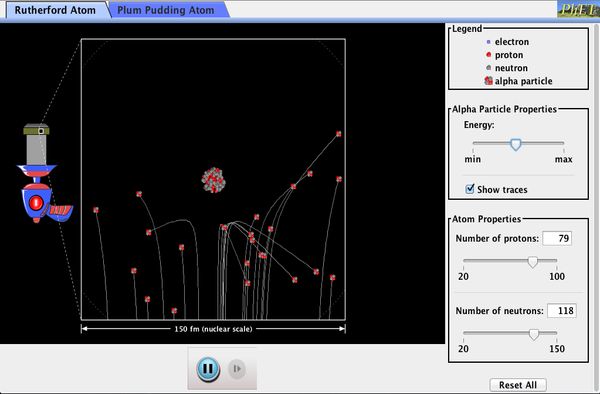
haga Clic aquí para descargar la simulación. Ejecutar usando Java.,
Resumen de la Sección
Problemas & Ejercicios
- Rutherford encontró que el tamaño del núcleo de unos 10-15 m. Esto implicaba un enorme densidad. ¿Cuál sería esta densidad para el oro?
- En el experimento de gotas de aceite de Millikan, uno observa una pequeña gota de aceite que se mantiene inmóvil entre dos placas. Tome el voltaje entre las placas para ser 2033 V, y la separación de la placa para ser 2.00 cm. La gota de aceite (de densidad 0,81 g/cm3) tiene un diámetro de 4,0 × 10-6 m. encontrar la carga en la gota, en términos de unidades de electrones.,
- (a) una aspirante a física quiere construir un modelo a escala de un átomo de hidrógeno para su proyecto de Feria de Ciencias. Si el átomo es de 1,00 m de diámetro, ¿qué tan grande debe tratar de hacer el núcleo? (b) How easy will this be to do?