respuesta larga. Primero, se debe hacer una distinción entre la polaridad de un enlace y la polaridad de una molécula (o compuesto).
La polaridad de Enlace se refiere a una separación de carga eléctrica que resulta de una diferencia en la electronegatividad entre los dos átomos o grupos que se unen entre sí.,
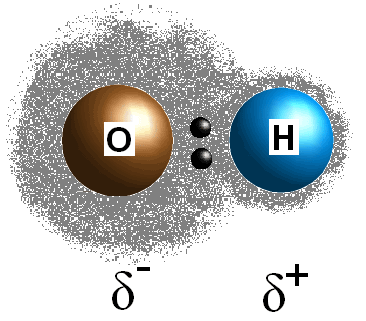
Esta diferencia en los valores de electronegatividad entre los dos átomos hace que los electrones del enlace se compartan de manera desigual, creando así una carga positiva (#delta^+#) en el átomo menos electronegativo y una carga negativa parcial (#delta^(-)#) en el átomo más electronegativo. La polaridad de un enlace se puede determinar utilizando únicamente los valores de electronegatividad de los dos átomos constituyentes.
si el enlace entre los dos átomos no es polar, es decir, la diferencia en electronegatividad entre los dos átomos es menor que 0.,5, entonces su molécula será no polar. Si el enlace es de hecho polar, puede proceder a tratar de determinar la polaridad de la molécula.
la geometría de una molécula es un factor importante en la determinación de la polaridad de una molécula. Estos cargos parciales antes mencionados dan lugar a un momento dipolar de bonos, #mu#.
si las orientaciones de estos momentos dipolares de enlace se cancelan entre sí, entonces se dice que la molécula es no polar. Sin embargo, si no lo hacen, se trata de una molécula polar.,
algunos ejemplos donde los momentos dipolares de enlace se cancelan entre sí, dando como resultado una molécula no polar:
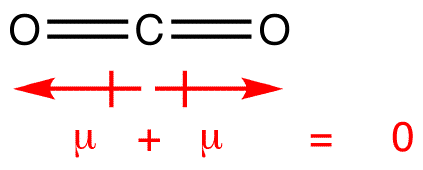
los momentos dipolares se dibujan con la flecha apuntando al átomo más electronegativo y el lado positivo en el átomo menos electronegativo. Observe que para #CO_2#, que tiene dos enlaces polares, el momento dipolar total es cero, ya que estas dos flechas se cancelan entre sí. Esto resulta en una molécula no polar., Lo mismo puede decirse de #BF_3#:
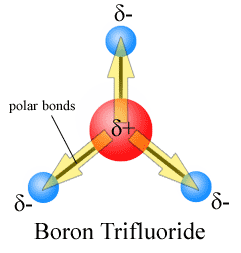
Los tres momentos dipolares se cancelan entre sí como resultado de la disposición simétrica de los enlaces (Ver más sobre la adición de vectores).
una disposición asimétrica de las cargas parciales da como resultado una molécula polar, como se puede ver para el agua:
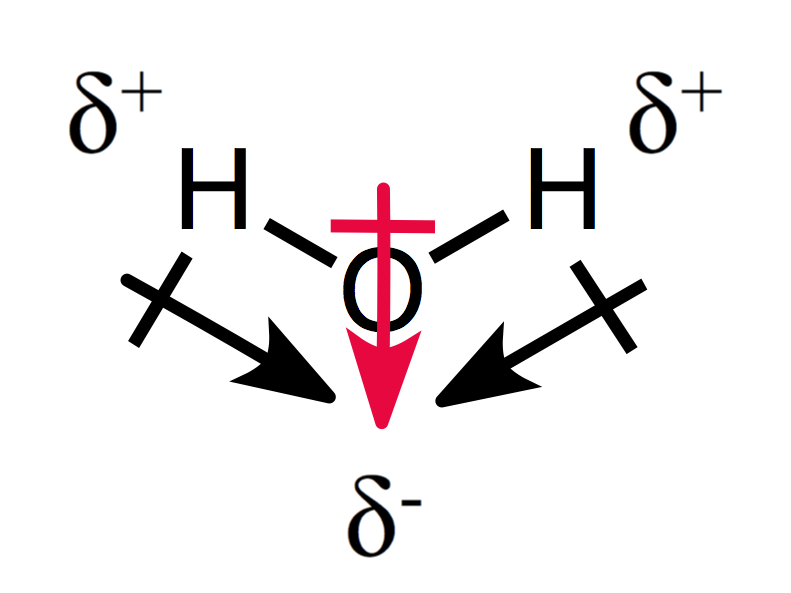
los dos momentos dipolares se suman entre sí creando un momento dipolar general, y por lo tanto una molécula polar.,
como conclusión, para predecir la polaridad de una molécula, debe estar familiarizado con las estructuras de Lewis, la electronegatividad, la teoría VSEPR y la polaridad de enlace.